Главная страница
 Базы данных
Базы данных
 База данных свойств веществ (поиск)
База данных свойств веществ (поиск)
Свойства вещества:
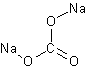
натрия карбонат
Синонимы и иностранные названия:
sodium carbonate (англ.)
натрий углекислый (рус.)
сода кальцинированная (рус.)
Название вещества с нормальным (не справочным) порядком слов русского языка:
карбонат натрияТип вещества:
неорганическое
Внешний вид:
бесцветн. моноклинные кристаллыБрутто-формула (по системе Хилла для органических веществ):
CNa2O3Формула в виде текста:
Na2CO3Молекулярная масса (в а.е.м.): 105,99
Температура плавления (в °C):
852Температуры полиморфных переходов (в °C):
моноклинные крист. (α) в моноклинные крист. (β) = 350°C, ΔHперехода = 0,8 кДж/моль
моноклинные крист. (β) в гексагональные крист. (γ) = 479°C, ΔHперехода = 2,1 кДж/моль
Растворимость (в г/100 г растворителя или характеристика):
N-метилпирролидон-2: 2,02 (при комнатной температуре) [Лит.]
аммиак жидкий: не растворим [Лит.]
ацетон: не растворим [Лит.]
бензонитрил: не растворим [Лит.]
вода: 7 (0°C) [Лит.]
вода: 12,2 (10°C) [Лит.]
вода: 21,8 (20°C) [Лит.]
вода: 29,4 (25°C) [Лит.]
вода: 39,7 (30°C) [Лит.]
вода: 48,8 (40°C) [Лит.]
вода: 47,3 (50°C) [Лит.]
вода: 46,4 (60°C) [Лит.]
вода: 45,1 (80°C) [Лит.]
вода: 44,7 (100°C) [Лит.]
вода: 42,7 (120°C) [Лит.]
вода: 39,3 (140°C) [Лит.]
гидразин: не растворим [Лит.]
глицерин: 98,3 (15°C) [Лит.]
диметилацетамид: 0,22 (при комнатной температуре) [Лит.]
диметилсульфоксид: 1,3 (при комнатной температуре) [Лит.]
диметилформамид: 0,4 (при комнатной температуре) [Лит.]
диметилформамид: 0,05 (25°C) [Лит.]
метанол: 0,55 (20°C) [Лит.]
метанол: 0,604 (25°C) [Лит.]
метанол: 0,3109 (25°C) [Лит.]
метанол: 0,7 (30°C) [Лит.]
метанол: 0,76 (35°C) [Лит.]
метилацетат: не растворим [Лит.]
пропанол 28%: 4,6 (20°C) [Лит.]
пропанол 50%: 1,2 (20°C) [Лит.]
пропанол 50%: 1,2 (20°C) [Лит.]
пропанол 62%: 0,4 (20°C) [Лит.]
сероуглерод: не растворим [Лит.]
сульфолан: 0,24 (при комнатной температуре) [Лит.]
углекислый газ жидкий: не растворим [Лит.]
этанол: 0,22 (20°C) [Лит.]
этанол: 0,24 (25°C) [Лит.]
этанол: 0,297 (35°C) [Лит.]
этанол 40%: 2,15 (29,7°C) [Лит.]
этанол 50%: 0,84 (20°C) [Лит.]
этанол 95%: 0,03 (30°C) [Лит.]
этилацетат: не растворим [Лит.]
этиленгликоль: 3,46 (20°C) [Лит.]
Фазовая и многокомпонентная растворимость (в масс%):
вода 36,4%, натрия карбонат 0,1%, пропан-2-ол 63,5%, 25 °C [Лит.]
вода 51,49%, натрия карбонат 0,91%, пропан-2-ол 47,6%, 25 °C [Лит.]
вода 61,86%, натрия карбонат 2,34%, пропан-2-ол 35,8%, 25 °C [Лит.]
вода 74,12%, натрия карбонат 6,54%, пропан-2-ол 19,34%, 25 °C [Лит.]
вода 78,8%, натрия карбонат 19,6%, пропан-2-ол 1,6%, 25 °C [Лит.]
(слой 1): вода 82,378%, натрия карбонат 14,213%, этанол 3,409%, (слой 2): вода 24,732%, натрия карбонат 0,109%, этанол 75,159%, 20 °C [Лит.]
Плотность:
2,53 (20°C, г/см3, состояние вещества - кристаллы)
Вкус, запах, гигроскопичность:
гигроскопичен
Способы получения:
- Реакцией сульфата натрия с углем и карбонатом кальция при 1000 С получают плав, обрабатывая который водой гидролизуют образующийся сульфид кальция, а карбонат натрия остается в растворе. [Лит.]
- Нагревание гидрокарбоната натрия при 100 С. [Лит.]
Реакции вещества:
- Ниже 32 С из водных растворов кристаллизуется декагидрат, в интервале 32-35 С - гексагидрат, выше 35 С - моногидрат, а выше 112,5 С - безводная соль. [Лит.]
- Реакция хлора с карбонатом натрия, содержащим 10% воды - это промышленный метод получения оксида хлора(I). [Лит.1]
2Cl2 + 2Na2CO3 + H2O → Cl2O + 2NaHCO3 + 2NaCl
2Cl2 + 2NaHCO3 → Cl2O + 2NaCl + 2CO2 + H2O
- Гидроксид натрия получают реакцией водного раствора карбоната натрия со взвесью гидроксида кальция в воде. [Лит.1]
Na2CO3 + Ca(OH)2 → 2NaOH + CaCO3
- Жидкий диоксид азота реагирует с карбонатами лития, натрия, магния, кальция и цинка с образованием соответственно нитратов лития, натрия, магния, кальция, цинка, углекислого газа и оксида азота(III). [Лит.1]
- При смешивании метанольного раствора трииодида таллия(I) с водным раствором карбоната натрия выпадает осадок оксида таллия(III), что связано с малой растворимостью оксида таллия(III) и увеличением окислительной силы иода в щелочной среде из-за образования гипоиодита. [Лит.1]
- Карбонат натрия может быть восстановлен до натрия алюминием, железом. Магний не подходит для восстановления, так как при нагревании смеси может произойти взрыв. [Лит.1]
Свойства растворов:
10% (вес.), растворитель - вода
Динамическая вязкость (мПа·с) = 1,754 (20°)
Плотность (г/см3) = 1,1029 (20°)
Показатель преломления для D-линии натрия = 1,3547 (20°)
Динамическая вязкость жидкостей и газов (в мПа·с):
3,4 (887°C)
2,32 (927°C)
1,63 (967°C)
Поверхностное натяжение (в мН/м):
211 (870°C)
209,6 (900°C)
207,1 (950°C)
204,6 (1000°C)
Стандартная энтальпия образования ΔH (298 К, кДж/моль)
-1130,7 (т) [Лит.]
Стандартная энергия Гиббса образования ΔG (298 К, кДж/моль)
-1044,4 (т) [Лит.]
Стандартная энтропия S (298 К, Дж/(моль·K))
135 (т) [Лит.]
Стандартная мольная теплоемкость Cp (298 К, Дж/(моль·K))
112,3 (т) [Лит.]
Энтальпия плавления ΔHпл (кДж/моль)
29,7 (т) [Лит.]
Летальная доза (ЛД50, в мг/кг):
4200 (крысы, внутрижелудочно)
2210 (мыши, подкожно)
Природные и антропогенные источники:
В природе встречается в виде грунтовых рассолов, рапы в озерах или в виде декагидрата - минерала натрона.
В СССР мощность месторождений природного карбоната натрия около 4 000 000 тонн. Крупные запасы карбоната натрия сосредоточены в США, Канаде, Кении, Мексике, ЮАР.
Дополнительная информация::
Раствор в воде имеет сильнощелочную реакцию. Реагирует с кислотами.
Источники информации:
- Comey A. M., Hahn D. A. A dictionary of Chemical Solubilities Inorganic. - 2 ed. - New York, The MacMillan Company, 1921. - С. 203-209
- Seidell A. Solubilities of inorganic and metal organic compounds. - 3ed., vol.1. - New York: D. Van Nostrand Company, 1940. - С. 1193-1214
- Вредные вещества в промышленности: Справочник для химиков, инженеров и врачей. - 7-е изд., Т.3. - Л.: Химия, 1976. - С. 325-326
- Вредные химические вещества: Неорганические соединения элементов I-IV групп. Справочник. - Л.: Химия, 1988. - С. 36
- Ефимов А.И. и др. Свойства неорганических соединений. Справочник. - Л.: Химия, 1983. - С. 164-165
- Рабинович В.А., Хавин З.Я. Краткий химический справочник. - Л.: Химия, 1977. - С. 84
- Справочник по растворимости. - Т.1, Кн.1. - М.-Л.: ИАН СССР, 1961. - С. 666
- Справочник химика. - Т. 2. - Л.-М.: Химия, 1964. - С. 144-145
- Химическая энциклопедия. - Т. 3. - М.: Советская энциклопедия, 1992. - С. 182-183
- Химический энциклопедический словарь. - Под ред. Кнунянц И.Л. - М.: Советская энциклопедия, 1983. - С. 363
Если не нашли нужное вещество или свойства можно выполнить следующие действия:
Если вы нашли ошибку на странице, выделите ее и нажмите Ctrl + Enter.
© Сбор и оформление информации: Руслан Анатольевич Кипер