Главная страница
 Базы данных
Базы данных
 База данных свойств веществ (поиск)
База данных свойств веществ (поиск)
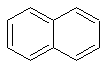
Свойства вещества:
нафталин
Синонимы и иностранные названия:
naphthalene (англ.)
Тип вещества:
органическое
Внешний вид:
бесцветн. моноклинные кристаллыБрутто-формула (по системе Хилла для органических веществ):
C10H8Молекулярная масса (в а.е.м.): 128,171
CAS №: 91-20-3
Температура плавления (в °C):
80,28Температура кипения (в °C):
217,96Растворимость (в г/100 г растворителя или характеристика):
1,1,2-трифтор-1,2,2-трихлорэтан: легко растворим [Лит.]
1-бутанол: 7,28 (11,7°C) [Лит.]
2-бутанол: 12,13 (28,7°C) [Лит.]
аммиак жидкий: 3,3 (0°C) [Лит.]
анилин: 25 (22°C) [Лит.]
ацетон: 32 (6,3°C) [Лит.]
ацетон: 64,9 (24,2°C) [Лит.]
бензол: 45,69 (15,6°C) [Лит.]
бензол: 59,2 (21°C) [Лит.]
вода: 0,003 (20°C) [Лит.]
вода: 0,00344 (25°C) [Лит.]
вода: 0,004153 (29,99°C) [Лит.]
вода: 0,00442 (34,5°C) [Лит.]
вода: 0,0244 (73,4°C) [Лит.]
гексан: 16,4 (20°C) [Лит.]
декалин: 25,5 (20°C) [Лит.]
декалин: 25,5 (20°C) [Лит.]
диметилсульфоксид: 27 (20,3°C) [Лит.]
диоксид серы: 30 (20°C) [Лит.]
диэтиловый эфир: 56,8 (25°C) [Лит.]
изобутанол: 6,8 (19,5°C) [Лит.]
изопропанол: 8,222 (24,2°C) [Лит.]
ксилол: 31,8 (13°C) [Лит.]
масляная кислота: 22,1 (21,5°C) [Лит.]
метанол: 8,1 (19,5°C) [Лит.]
метанол: 10 (25°C) [Лит.]
метанол: 41,5 (55°C) [Лит.]
метилформиат: 33,9 (25°C) [Лит.]
муравьиная кислота 95%: 0,3 (18,5°C) [Лит.]
нитробензол: 42,46 (24°C) [Лит.]
нонафторбутоксинонафторбутан: 0,0727 (25°C) [Лит.]
нонафторбутоксинонафторбутан: 0,1139 (35°C) [Лит.]
п-цимол: 14,22 (30°C) [Лит.]
пентакарбонил железа: очень мало растворим [Лит.]
перфтортрибутиламин: 0,05747 (25°C) [Лит.]
перфтортрибутиламин: 0,08845 (35°C) [Лит.]
пропанол: 8,5 (20°C) [Лит.]
пропанол: 100 (60°C) [Лит.]
сероуглерод: 57 (20°C) [Лит.]
тетралин: 66,7 (23°C) [Лит.]
тетрахлорметан: 13,9 (6°C) [Лит.]
тетрахлорметан: 32,74 (28,2°C) [Лит.]
толуол: 40,3 (15,5°C) [Лит.]
толуол: 48 (20°C) [Лит.]
трет-бутанол: 12,07 (31,6°C) [Лит.]
уксусная кислота: 6,8 (6,75°C) [Лит.]
уксусная кислота: 13,1 (21,5°C) [Лит.]
фтороводород: плохо растворим [Лит.]
хинолин: 3,02 (20°C) [Лит.]
хлорбензол: 47,04 (22,1°C) [Лит.]
хлороформ: 46,6 (20°C) [Лит.]
хромила хлорид: растворим с реакцией [Лит.]
циклогексанол: 13,3 (20°C) [Лит.]
этанол абсолютный: 5,29 (15°C) [Лит.]
Плотность:
1,168 (22°C, г/см3, состояние вещества - кристаллы)
0,9625 (100°C, г/см3, состояние вещества - жидкость)
Некоторые числовые свойства вещества:
Год открытия: 1819 (Гарденом)
Нормативные документы, связанные с веществом:
- Гигиенические нормативы (ГН) № 2.1.5.1315-03 "Предельно допустимые концентрации (ПДК) химических веществ в воде водных объектов хозяйственно-питьевого и культурно-бытового водопользования " (Описание документа: ПДК в питьевой воде; Документ устарел.)
- предельно допустимая концентрация (мг/л) в питьевой воде = 0,01
- МУК № 4.1.1044-01 "Хромато-масс-спектрометрическое определение полициклических ароматических углеводородов в воздухе" (Описание документа: Концентрирование на адсорбент, экстракция эфиром, упаривание, реэкстракция хлороформом, ГЖХ/МС на капиллярной колонке.)
- МУК № 4.1.1062-01 "Хромато-масс-спектрометрическое определение труднолетучих органических веществ в почве и отходах производства и потребления"
- МУК № 4.1.618-96 "Методические указания по хромато-масс-спектрометрическому определению летучих органических веществ в атмосферном воздухе"
- ПНД В МСУ Хж № 3.4-018-04 "Методика выполнения измерений массовых концентраций полициклических ароматических углеводородов в пробах сточных, очищенных сточных и природных вод методом высокоэффективной жидкостной хроматографии с флуориметрическим детектированием" (Описание документа: Экстракция из воды гексаном, концентрирование, очистка экстракта и ВЭЖХ анализ с градиентным элюированием и флуориметрическим детектированием.)
- ПНД В МСУ Хж № 5.6-024-06 "Методика выполнения измерений массовых концентраций полициклических ароматических углеводородов в пробах почвы и донных отложений методом высокоэффективной жидкостной хроматографии" (Описание документа: Экстракция ПАУ ацетоном, реэкстракция гексаном, очистка экстракта, концентрирование и ВЭЖХ анализ с градиентным элюированием и флуориметрическим детектированием.)
- ПНД Ф № 14.1:2:4.70-96 издание 2004 г "Методика выполнения измерений массовой концентрации полициклических ароматических углеводородов в пробах питьевых, природных и сточных вод хроматографическим методом ВЭЖХ" (Описание документа: Анализ вод методом ВЭЖХ после экстракции гексаном.)
- Приказ государственного комитета Российской Федерации по рыболовству № 96 от 28.04.1999 "О рыбохозяйственных нормативах" (Описание документа: ПДК и ОБУВ для водных объектов, имеющих рыбохозяйственное значение.)
- предельно допустимая концентрация (мг/л) в природной воде = 0,004
- Приказ федерального агентства по рыболовству № 20 от 18.01.2010 "Об утверждении нормативов качества воды водных объектов рыбохозяйственного значения, в том числе нормативов предельно допустимых концентраций вредных веществ в водах водных объектов рыбохозяйственного значения" (Описание документа: ПДК для водных объектов, имеющих рыбохозяйственное значение.)
- предельно допустимая концентрация (мг/л) в природной воде = 0,004
- Санитарные правила и нормы (СанПиН) № 2.1.4.1074-01 от 26.09.2001 "Питьевая вода. Гигиенические требования к качеству воды централизованных систем питьевого водоснабжения. Контроль качества" (Описание документа: ПДК в воде централизованного водоснабжения; Документ устарел.)
- предельно допустимая концентрация (мг/л) в питьевой воде = 0,01
Способы получения:
- Нагреванием нафталин-1-альдегида с 1% палладием на угле в атмосфере углекислого газа при 220 С в течение 30 минут. (выход 80%) [Лит.]
- 1-Метоксинафталин реагирует с этилмеркаптаном в присутствии хлорида алюминия в дихлорметане с образованием нафталина. Выход 90%. [Лит.1
 ]
]
2C10H7OCH3 + 2C2H5SH → 2C10H8 + 2CH3OH + C2H5SSC2H5
Используется для синтеза веществ:
1,4-нафтохинон
1-бромнафталин
Реакции вещества:
- Реагирует с формальдегидом и хлороводородом с образованием 1-(хлорметил)нафталина. [Лит.]
- Реагирует с 2-нитропропеном в трифторметансульфокислоте при -40 °С в течение 10 минут с образованием 1-нафтилпропан-2-она. (выход 86%) [Лит.]
- Реагирует с иодом в присутствии надуксусной кислоты в тетрахлорметане при 60 С в течение 3 часов с образованием 1-иоднафталина. (выход 59%) [Лит.]
- В спиртовом растворе реагирует с натрием с образованием 1,4-дигидронафталина. [Лит.]
- Реагирует с бензоилхлоридом в присутствии хлорида алюминия с образованием 1-бензоилнафталина. (выход 78%) [Лит.]
- Нитруется 90% азотной кислотой с образованием 1-нитронафталина до уменьшения концентрации кислоты до 65%. [Лит.]
- Нитруется смесью азотной и серной кислот до 1-нитронафталина с примесью 4-5% 2-нитронафталина. [Лит.]
- При 150 С присоединяет дицианоацетилен. [Лит.]
- Ниже 100 С сульфируется концентрированной серной кислотой до нафталин-1-сульфокислоты. [Лит.]
- Выше 150 С сульфируется концентрированной серной кислотой до нафталин-2-сульфокислоты. [Лит.]
- Ацетилируется ацетилхлоридом в сероуглероде в присутствии хлорида алюминия с образованием 1-ацетилнафталина. (выход 92%) [Лит.]
- Окисляется кислородом над оксидом ванадия(V) при 400-450 °С до фталевого ангидрида. (выход 85%) [Лит.]
- Гидрируется водородом над диоксидом платины в уксусной кислоте при 50 °С и давлении 4 атм до тетралина. [Лит.]
- Гидрируется водородом над диоксидом платины в уксусной кислоте при 100 °С и давлении 10 атм до декалина (смесь цис- и транс-изомеров). [Лит.]
- Хлорируется хлором в присутствии хлорида железа(III) с образованием смеси 1- и 2-хлорнафталинов (90:10). [Лит.]
- Окисляется перманганатом калия в щелочной среде при нагревании до солей фталевой и фталоновой кислот (24:76). [Лит.]
- Реагирует с метил(трифторметил)диоксираном с образованием 1,2;3,4-диэпокси-1,2,3,4-тетрагидронафталина. (выход 98%) [Лит.]
- 1-(Хлорметил)нафталин можно получить реакцией нафталина с формальдегидом и хлороводородом. Выход 35-95%. [Лит.1
 ]
]
C10H8 + CH2O + HCl → C10H7CH2Cl + H2O
- 1-Цианонафталин может быть получен реакцией нафталина с цианидом натрия и кислородом в 90% ацетонитриле в присутствии 9-цианофенантрена и облучении светом длиной волны 350 нм. Выход 65%. [Лит.1
 ]
] - Нафталин реагирует с натрием в 1,2-диметоксиэтане или тетрагидрофуране при перемешивании при комнатной температуре в течение 2 часов в атмосфере азота с образованием темно-зеленых электропроводящих растворов анион-радикальной соли нафталин-натрия. [Лит.1
 ]
] - Фталоновую кислоту можно получить кипячением нафталина с перманганатом калия в воде в течение 3-4 часов. [Лит.1
 ]
]
Реакции, в которых вещество не участвует:
- Не реагирует с трет-бутилгипохлоритом. [Лит.]
Давление паров (в мм рт.ст.):
0,0648 (20°C)
0,177 (30°C)
1 (50,1°C)
5 (74,2°C)
6,96 (80°C)
10 (85,8°C)
20 (101,7°C)
40 (119,4°C)
60 (130,2°C)
100 (144°C)
200 (167,7°C)
400 (191,5°C)
Показатели диссоциации:
pKBH+ (1) = -4 (0°C, фтороводород, положение 1)
Индекс удерживания для газовой хроматографии:
1183,4 (фаза колонки - DB-5, со скоростью подъема температуры 6 К/мин)
Логарифм давления насыщенного пара (в мм.рт.ст.): lg p = 7,184 - 1815,3/(T - 273,15 + 206,1) (при T = 283-383 K)
Некоторые нечисловые свойства вещества:
перегоняется с водяным паром
Летальная доза (ЛД50, в мг/кг):
1250 (крысы, )
1200 (морские свинки, )
580 (мыши, )
Спектральные свойства вещества:
Протонный магнитный резонанс (миллионные доли (м.д.)) = 7,81 (к тетраметилсилану H(1))
Протонный магнитный резонанс (миллионные доли (м.д.)) = 7,46 (к тетраметилсилану H(2))
Ультрафиолетовый/видимый спектр (максимум в нм, толщина слоя 1 см, в скобках - экстинция) = 320 (в этаноле)
Ультрафиолетовый/видимый спектр (максимум в нм, толщина слоя 1 см, в скобках - экстинция) = 275 (в этаноле)
Ультрафиолетовый/видимый спектр (максимум в нм, толщина слоя 1 см, в скобках - экстинция) = 312 (в этаноле)
Ультрафиолетовый/видимый спектр (максимум в нм, толщина слоя 1 см, в скобках - экстинция) = 286 (в этаноле)
Критическая температура (в °C):
475,2Критическое давление (в МПа):
4,051Применение:
Ранее применялся для борьбы с молью, но уступил место более эффективным инсектицидам. В производстве фталевого ангидрида, тетралина, декалина, нафтолов, азокрасителей.
История:
Открыт в каменноугольной смоле Гарденом в 1820 г; название его предложено Дж. Киддом изучавшим его физические свойства в том же году. В 1826 г. Фарадей установил эмпирическую формулу нафталина C5H4, а в 1866 г. Эрленмейер предложил структуру из двух конденсированных бензольных колец.
Дополнительная информация::
Дает гетерогенный азеотроп с водой (8,9 г нафталина с 49,4 г воды, т.кип. 98,8 С при 750 мм.рт.ст.).
Источники информации:
- Seidell A. Solubilities of organic compounds. - 3ed., vol.2. - New York: D. Van Nostrand Company, 1941. - С. 647-658
- Yalkowsky S.H., Yan H. Handbook of aqueous solubility data. - CRC Press, 2003. - С. 632-634
- Yalkowsky S.H., Yan H., Jain P. Handbook of aqueous solubility data. – 2nd ed. - CRC Press, 2010. - С. 647-649
- Вредные химические вещества: Углеводороды, галогенпроизводные углеводородов. Справочник. - Л.: Химия, 1990. - С. 219-226, 688-689
- Гуревич Д.А. Фталевый ангидрид. - М.: Химия, 1968. - С. 198-200
- Дональдсон Н. Химия и технология соединений нафталинового ряда. - М.: ГНТИХЛ, 1963. - С. 11-72
- Другов Ю.С., Родин А.А. Мониторинг органических загрязнений природной среды. - СПб.: Наука, 2004. - С. 129, 423, 708
- Клар Э. Полициклические углеводороды. - Т.1. - М.: Химия, 1971. - С. 209-220
- Корольченко А.Я., Корольченко Д.А. Пожаровзрывоопасность веществ и материалов и средства их тушения. - 2 изд, Ч.2. - М.: Ассоциация Пожнаука, 2004. - С. 179
- Краткая химическая энциклопедия. - Т. 3: Мальтаза-Пиролиз. - М.: Советская энциклопедия, 1964. - С. 389-391
- Краткий справочник физико-химических величин. - Под ред. Мищенко К.П., Равделя А.А. - Л.: Химия, 1974. - С. 68-69
- Полюдек-Фабини Р., Бейрих Т. Органический анализ. - Л.: Химия, 1981. - С. 30
- Промышленные хлорорганические продукты: Справочник. - М.: Химия, 1978. - С. 629-631
- Справочник по растворимости. - Т.1, Кн.2. - М.-Л.: ИАН СССР, 1962. - С. 972, 1033, 1192, 1232-1233, 1297-1298, 1345-1346, 1402, 1434-1435, 1461, 1469, 1496-1497, 1515-1517, 1530-1534
- Справочник химика. - Т. 2. - Л.-М.: Химия, 1964. - С. 810-811
- Шатенштейн А.И., Петров Э.С. Влияние растворителей на образование и ионную диссоциацию аддуктов щелочных металлов с ароматическими углеводородами / Успехи химии. - 1967. - Т.36, №2. - С. 269-287 (немного про натрий-нафталин)
- Химическая энциклопедия. - Т. 3. - М.: Советская энциклопедия, 1992. - С. 190-191
- Химический энциклопедический словарь. - Под ред. Кнунянц И.Л. - М.: Советская энциклопедия, 1983. - С. 366
Если не нашли нужное вещество или свойства можно выполнить следующие действия:
Если вы нашли ошибку на странице, выделите ее и нажмите Ctrl + Enter.
© Сбор и оформление информации: Руслан Анатольевич Кипер