Главная страница
 Базы данных
Базы данных
 База данных свойств веществ (поиск)
База данных свойств веществ (поиск)
Свойства вещества:
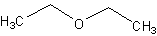
этоксиэтан
Синонимы и иностранные названия:
diethyl ether (англ.)
диэтиловый эфир (рус.)
серный эфир (рус.)
этиловый эфир (рус.)
Тип вещества:
органическое
Внешний вид:
бесцветн. жидкостьКристаллические модификации, структура молекулы, цвет растворов и паров:
В твердом виде - ромбические кристаллы.
Брутто-формула (по системе Хилла для органических веществ):
C4H10OФормула в виде текста:
C2H5OC2H5Молекулярная масса (в а.е.м.): 74,12199
Температура плавления (в °C):
-116,3Температура кипения (в °C):
35,6Продукты термического разложения:
ацетальдегид; этан; Растворимость (в г/100 г растворителя или характеристика):
1,1,2-трифтор-1,2,2-трихлорэтан: смешивается [Лит.]
аммиак жидкий: смешивается [Лит.]
ацетон: хорошо растворим [Лит.]
бензол: смешивается [Лит.]
вода: 10,45 (0°C) [Лит.]
вода: 9,92 (7,5°C) [Лит.]
вода: 8,291 (10°C) [Лит.]
вода: 6,5 (20°C) [Лит.]
вода: 5,069 (30°C) [Лит.]
вода: 2,9 (72°C) [Лит.]
вода: 2,7 (82°C) [Лит.]
глицерин 99,04%: 0,65 (20°C) [Лит.]
диэтиленгликоль: 19,5 (25°C) [Лит.]
кислород жидкий: 0,0009 (-183°C) [Лит.]
лигроин: хорошо растворим [Лит.]
серная кислота: растворим [Лит.]
фтороводород: легко растворим [Лит.]
хлороводород жидкий безводный: растворим [Лит.]
хлороформ: смешивается [Лит.]
этанол: смешивается [Лит.]
этиленгликоль: 8,5 (25°C) [Лит.]
Плотность:
0,7362 (0°C, г/см3, состояние вещества - жидкость)
0,7248 (10°C, г/см3, состояние вещества - жидкость)
0,7135 (20°C, г/см3, состояние вещества - жидкость)
0,70778 (25°C, г/см3, состояние вещества - жидкость)
0,7019 (30°C, г/см3, состояние вещества - жидкость)
Некоторые числовые свойства вещества:
Год начала применения вещества: 1846 (как средства для ингаляционного наркоза)
Поляризуемость молекул (нм3): 0,01
Порог восприятия запаха в воздухе (мг/л): 0,001
Скорость выгорания со свободной поверхности (кг/(м2·ч)): 125,84
Нормативные документы, связанные с веществом:
- Гигиенические нормативы (ГН) № 2.1.5.1315-03 "Предельно допустимые концентрации (ПДК) химических веществ в воде водных объектов хозяйственно-питьевого и культурно-бытового водопользования " (Описание документа: ПДК в питьевой воде; Документ устарел.)
- предельно допустимая концентрация (мг/л) в питьевой воде = 0,3
- Постановление правительства РФ № 681 от 30.06.1998 "Об утверждении перечня наркотических средств, психотропных веществ и их прекурсоров, подлежащих контролю в Российской Федерации" (Описание документа: Списки наркотических и психотропных веществ.)
- список = 4 (прекурсор, таблица III, с концентрацией 45% и более)
Метод очистки или выделения из смесей 1:
Источник информации: Гитис С.С., Глаз А.И., Иванов А.В. Практикум по органической химии: Органический синтез. - М.: Высшая школа, 1991 стр. 47Удалить пероксиды можно действием щелочей или восстановителей — сульфита натрия или соли железа (II). В первом случае эфир встряхивают с порошкообразным гидроксидом калия. Восстановление осуществляют насыщенным на холоду и разбавленным затем в три раза водой раствором сульфита натрия или концентрированным подкисленным раствором соли железа (II). Очистку ведут до тех пор, пока проба перестанет давать реакцию на перокснды. На 1 л эфира берут около 70 г щелочи, 70... 75 мл раствора сульфита натрия или 10...20 мл концентрированного раствора соли железа (11), разбавленного 100 мл воды. Исходный раствор соли железа готовят из 60 г кристаллического сульфата железа (II), 6 мл концентрированной серной кислоты и 110 мл воды, либо из 100 г хлорида железа (II), 42 мл концентрированной соляной кислоты и 85 мл воды.
Метод очистки или выделения из смесей 2:
Источник информации: Гитис С.С., Глаз А.И., Иванов А.В. Практикум по органической химии: Органический синтез. - М.: Высшая школа, 1991 стр. 47-48Очищенный от пероксидов эфир для удаления примеси этилового спирта промывают водой, а затем насыщенным на холоду раствором хлорида кальция. Промытый эфир переливают в склянку, закрывающуюся корковой пробкой, вносят в нее 150 г безводного хлорида кальция и оставляют стоять не менее чем на сутки, время от времени перемешивая смесь. Затем эфир фильтруют через большой складчатый фильтр в чистую, сухую склянку, следя за тем, чтобы все горелки в радиусе 3 м были выключены. В эфир вносят тонко нарезанные кусочки натрия, очищенного от оксидов, и закрывают корковой пробкой с хлоркальциевой трубкой. Если водород больше не выделяется и поверхность свежих кусочков натрия остается блестящей, то склянку закрывают хорошей корковой пробкой и ставят в темное место. Если поверхность натрня сильно изменилась, необходимо отфильтровать эфир в другую сухую темную склянку и повторить обработку натрием. Иногда эфир дополнительно перегоняют над натрием со всеми предосторожностями, используя предварительно нагретую воздушную баню.
Реакции вещества:
- Пропускание сухого хлора при -30 - -25 С дает 1-хлор-1-этоксиэтан. [Лит.]
- В парах при 340 С начинает реагировать с натрием, давая этоксид натрия, гидрид натрия и этилен. [Лит.]
- Разлагается выше 500 С с образованием ацетальдегида и этана. [Лит.]
- Натрий полностью разлагает диэтиловый эфир при нагревании в запаяной трубке при 200-340 С в течение 5 часов. [Лит.1]
- Пары диэтилового эфира могут самовоспламеняться в атмосфере хлора. [Лит.1]
(C2H5)2O + 4Cl2 → 4C + 8HCl + H2O
- Гидросульфат нитрозила реагирует с диэтиловым эфиром расщепляя его на этилсерную кислоту и этилнитрит. [Лит.1]
NOHSO4 + (C2H5)2O → C2H5OSO3H + C2H5ONO
- Пероксид натрия воспламеняет глицерин, ледяную уксусную кислоту, молочную кислоту, параформальдегид, миндальное масло и диэтиловый эфир. [Лит.1]
- Диэтиловый эфир медленно реагирует с хлорным ангидридом с образованием этилперхлората. [Лит.1]
- Пероксид натрия способен воспламенять при контакте: метанол, этанол, пропанол, бутанол, изоамиловый спирт, бензиловый спирт, этиленгликоль, диэтиловый эфир, анилин, скипидар, уксусную кислоту. [Лит.1]
- Хромовый ангидрид воспламеняет при контакте: метанол, этанол, бутанол, изоамиловый спирт, изобутанол, диэтиловый эфир, уксусную кислоту, ацетон, ацетальдегид, бутаналь, бензальдегид, пропаналь, паральдегид, этилацетат, амилацетат, пеларгоновую кислоту. [Лит.1]
- Диэтиловый эфир бурно реагирует с хлором при комнатной температуре давая сложную смесь продуктов. Сначала замещается хлор в положении 1, затем все водороды в положении 2 и затем оставшийся водород в положении 1. При этом еще происходит отщепление хлороводорода и присоединение хлора к образовавшимся виниловым эфирам. [Лит.1]
Показатель преломления (для D-линии натрия):
1,3526 (20°C)
Давление паров (в мм рт.ст.):
1 (-74,3°C)
10 (-48,1°C)
40 (-27,7°C)
200 (2,2°C)
400 (17°C)
Показатели диссоциации:
pKBH+ (1) = -3,59 (20°C, вода)
Диэлектрическая проницаемость:
4,3 (25°C)
Дипольный момент молекулы (в дебаях):
1,15 (20°C)
Динамическая вязкость жидкостей и газов (в мПа·с):
0,242 (20°C)
Поверхностное натяжение (в мН/м):
17,01 (20°C)
Скорость звука в веществе (в м/с):
206,5 (97,1°C, состояние среды - газ)
Стандартная энтальпия образования ΔH (298 К, кДж/моль):
-279,5 (ж)Стандартная энтропия вещества S (298 К, Дж/(моль·K)):
172,4 (ж)Стандартная мольная теплоемкость Cp (298 К, Дж/(моль·K)):
175,6 (ж)Энтальпия кипения ΔHкип (кДж/моль):
26,6Температура вспышки в воздухе (°C):
-41Температура самовоспламенения на воздухе (°C):
164Теплота сгорания (кДж/моль):
2726,7Стандартная энтальпия образования ΔH (298 К, кДж/моль):
-252,1 (г)Стандартная энтропия вещества S (298 К, Дж/(моль·K)):
342,7 (г)Стандартная мольная теплоемкость Cp (298 К, Дж/(моль·K)):
119,5 (г)Летальная доза (ЛД50, в мг/кг):
1760 (белые мыши, перорально)
Природные и антропогенные источники:
Выделяется в небольшой концентрации гречихой при цветении.
Информация из сети Интернет или других непостоянных источников:
Растворимость диэтилового эфира в 10% водном растворе хлорида натрия при комнатной температуре около 2 мл в 100 мл раствора [опыт].
Критическая температура (в °C):
193,4Критическое давление (в МПа):
3,61Правила обращения с веществом:
При хранении с кислородом воздуха легко образует пероксиды, которые могут взорваться при перегонке диэтилового эфира (особенно досуха). В некоторые партии диэтилового эфира в промышленности добавляют антиоксиданты (обычно пирогаллол 50-200 мг/кг, иногда диэтилдитиокарбамат натрия). Следы металлов ускоряют окисление, следы воды несколько замедляют его. Нагревание и освещение ускоряет образование пероксидов. Для длительного хранения рекомендуется удалять кислород из емкости с диэтиловым эфиром.
Обнаружение пероксидов. Для обнаружения пероксидов можно использовать следующие методы:
В закрытой пробирке встряхивают в течение 1 минуты 10 мл эфира и 1 мл свежеприготовленного 10% раствора иодида калия. При рассматривании на фоне белого экрана не должно быть заметно окрашивания. Появление желтого окрашивания эфирного слоя указывает на наличие пероксидов. Предел чувствительности метода 0,005% пероксида.
В 50 мл 18% соляной кислоты растворяют 9 г железного купороса, добавляют 100-200 мг порошка цинка и 5 г тиоцианата натрия. После исчезновения красного окрашивания добавляют еще 12 г тиоцианата натрия и декантируют раствор с непрореагировавшего цинка в склянку с притертой пробкой. Затем к 1 мл реагента в пробирке из бесцветного стекла добавляют 1 каплю анализируемого эфира. Появление красного окрашивания указывает на наличие пероксидов. Предел чувствительности метода 0,001% пероксида.
К 1 мл воды, содержащей 1 мг дихромата натрия и 1 каплю разбавленной серной кислоты, добавляют 2-3 мл эфира. При наличии пероксидов органический слой приобретает голубую окраску пероксида хрома.
Удаление пероксидов.
Пероксиды можно удалить из эфира выдерживанием над оксидом алюминия для хроматографии в течение суток, перемешиванием с ним растворителя в течение 1-1,5 часов или пропусканием растворителя через колонку с оксидом алюминия. Адсорбированные пероксиды не дожидаясь высыхания растворителя разрушают 5% раствором сульфата железа(II).
Пероксиды можно также удалить пропусканием эфира, через колонку с анионообменной смолой.
Перегонку эфира с пероксидами можно произвести, добавив в перегонную колбу либо хлорид меди(I) или хлорид олова(II) в количестве 5 г/л, либо гидрохинон в количестве 1 г/л.
Пероксиды могут быть экстрагированы из эфира 23% едким натром смешиванием 1 объема едкого натра с 10 объемами эфира на 30 минут.
Для быстрого удаления пероксидов используют восстановители. наибольшее распространение получили 30% раствор сульфата железа(II), раствор дисульфита натрия, сульфида натрия. Пероксиды полностью удаляются встряхиванием в делительной воронке с раствором восстановителя за 3-5 минут.
Обработка гранулированной щелочью в твердом виде, как правило не приводит к удалению пероксидов даже при кипячении растворителя. Распространенное мнение, что при хранении над гранулированной щелочью не образуются пероксиды ошибочно.
Диэтиловый эфир относится к легковоспламеняющимся жидкостям и его пары могут образовывать взрывоопасные смеси с воздухом. Тяжелые пары диэтилового эфира могут распространятся на 3-5 метров по поверхностям и воспламенятся от источника зажигания. Для работы с диэтиловым эфиром необходима хорошая вентиляция в зоне работ.
Применение вещества:
- лекарственное средство: препарат для ингаляционного наркоза [Лит.]
Источники информации:
- CRC Handbook of Chemistry and Physics. - 90ed. - CRC Press, 2010. - С. 5-27
- Seidell A. Solubilities of organic compounds. - 3ed., vol.2. - New York: D. Van Nostrand Company, 1941. - С. 271-277
- Yalkowsky S.H., Yan H., Jain P. Handbook of aqueous solubility data. – 2nd ed. - CRC Press, 2010. - С. 130-131
- Альберт А., Сержент Е. Константы ионизации кислот и оснований. - М.-Л.: Химия, 1964. - С. 138
- Бабаян Э.А., Гаевский А.В., Бардин Е.В. Правовые аспекты оборота наркотических, психотропных, сильнодействующих, ядовитых веществ и прекурсоров. - М.: МЦФЭР, 2000. - С. 148
- Гурвич Я.А. Справочник молодого аппаратчика-химика. - М.: Химия, 1991. - С. 229
- Гутман В. Химия координационных соединений в неводных растворах. - М.: Мир, 1971. - С. 188-190 (диэтиловый эфир как растворитель)
- Девяткин В.В., Ляхова Ю.М. Химия для любознательных, или о чем не узнаешь на уроке. - Ярославль: Академия Холдинг, 2000. - С. 48
- Захаров Л.Н. Техника безопасности в химических лабораториях. - Л.: Химия, 1991. - С. 167-176 (техника безопасности)
- Некрасов Б.В. Основы общей химии. - Т.1. - М.: Химия, 1973. - С. 559
- Рабинович В.А., Хавин З.Я. Краткий химический справочник. - Л.: Химия, 1977. - С. 148
- Справочник по растворимости. - Т.1, Кн.1. - М.-Л.: ИАН СССР, 1961. - С. 408-409
- Справочник химика. - 2 изд., Т.1. - Л.-М.: Химия, 1966. - С. 554
- Хёрд Ч.Д. Пиролиз соединений углерода. - Л.-М.: ГОНТИ РКТП СССР, 1938. - С. 185
- Химический энциклопедический словарь. - Под ред. Кнунянц И.Л. - М.: Советская энциклопедия, 1983. - С. 194-195
Если не нашли нужное вещество или свойства можно выполнить следующие действия:
Если вы нашли ошибку на странице, выделите ее и нажмите Ctrl + Enter.
© Сбор и оформление информации: Руслан Анатольевич Кипер