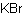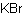Главная страница
 Базы данных
Базы данных
 База данных свойств веществ (поиск)
База данных свойств веществ (поиск)
Свойства вещества:
калия бромид
Синонимы и иностранные названия:
potassium bromide (англ.)
калий бромистый (рус.)
Название вещества с нормальным (не справочным) порядком слов русского языка:
бромид калияТип вещества:
неорганическое
Внешний вид:
бесцветн. кубические кристаллыБрутто-формула (по системе Хилла для органических веществ):
BrKФормула в виде текста:
KBrМолекулярная масса (в а.е.м.): 119,002
Температура плавления (в °C):
730Температура кипения (в °C):
1380Растворимость (в г/100 г растворителя или характеристика):
1-бутанол: 0,0112 (20°C) [Лит.]
1-бутанол: 0,0148 (50°C) [Лит.]
1-пентанол: 0,003 (25°C) [Лит.]
2-бутанол: 0,0044 (25°C) [Лит.]
N-метилформамид: 5,57 (25°C) [Лит.]
аммиак жидкий: 40,32 (-33,9°C) [Лит.]
аммиак жидкий: 26,87 (0°C) [Лит.]
аммиак жидкий: 13,5 (25°C) [Лит.]
ацетон: 0,00454 (18°C) [Лит.]
ацетон: 0,00415 (37°C) [Лит.]
ацетонитрил: 0,023 (18°C, плотность насыщенного раствора = 0,782) [Лит.]
ацетонитрил: 0,024 (25°C, плотность насыщенного раствора = 0,777) [Лит.]
бром жидкий: 0,0185 (25°C) [Лит.]
вода: 53,5 (0°C) [Лит.]
вода: 59,5 (10°C) [Лит.]
вода: 65,2 (20°C) [Лит.]
вода: 68,1 (25°C) [Лит.]
вода: 70,9 (30°C) [Лит.]
вода: 75,8 (40°C) [Лит.]
вода: 85,5 (60°C) [Лит.]
вода: 94,6 (80°C) [Лит.]
вода: 103,3 (100°C) [Лит.]
вода: 127,3 (150°C) [Лит.]
вода: 153,2 (200°C) [Лит.]
вода тяжелая: 42,45 (5°C) [Лит.]
вода тяжелая: 51,75 (20°C) [Лит.]
вода тяжелая: 67,22 (50°C) [Лит.]
вода тяжелая: 89 (100°C) [Лит.]
гидразин: 60 (20°C) [Лит.]
гидроксиламин: 44,7 (18°C) [Лит.]
глицерин: 17,8 (25°C) [Лит.]
диметилсульфоксид: 5,03 (25°C) [Лит.]
диметилсульфоксид: 3,24 (29,7°C) [Лит.]
диметилсульфоксид: 3,86 (73,6°C) [Лит.]
диметилформамид: 0,91 (25°C) [Лит.]
диоксид серы: 2,81 (0°C) [Лит.]
диэтиловый эфир: 0,02 (15°C) [Лит.]
изоамиловый спирт: 0,002 (20°C) [Лит.]
изоамиловый спирт: 0,00175 (25°C) [Лит.]
изобутанол: 0,0076 (25°C) [Лит.]
изопропанол: 0,011 (25°C) [Лит.]
метанол: 1,82 (0°C) [Лит.]
метанол: 1,93 (10°C) [Лит.]
метанол: 2 (15°C) [Лит.]
метанол: 2,08 (20°C) [Лит.]
метанол: 2,17 (25°C) [Лит.]
метанол: 2,23 (30°C) [Лит.]
метанол: 2,37 (40°C) [Лит.]
метанол: 2,55 (50°C) [Лит.]
метанол: 2,74 (60°C) [Лит.]
монохлорид иода: растворим [Лит.]
муравьиная кислота 95%: 23,2 (18,5°C) [Лит.]
оксид-трихлорид фосфора(V): 0,031 (20°C) [Лит.]
пиридин: мало растворим [Лит.]
пропанол: 0,035 (25°C) [Лит.]
пропиленкарбонат: 0,0474 (25°C) [Лит.]
пропиленкарбонат: 0,0453 (30°C) [Лит.]
пропиленкарбонат: 0,0447 (35°C) [Лит.]
пропиленкарбонат: 0,0459 (40°C) [Лит.]
пропиленкарбонат: 0,0499 (45°C) [Лит.]
тетрагидрофуран: 0,0337 (25°C) [Лит.]
трихлорид сурьмы: хорошо растворим [Лит.]
уксусная кислота: 0,2187 (30°C) [Лит.]
формамид: 21,5 (25°C) [Лит.]
фурфурол: 0,12 (25°C) [Лит.]
циановодород: мало растворим [Лит.]
этанол: 0,135 (25°C) [Лит.]
этанол 50%: 16,4 (20°C) [Лит.]
этаноламин: 3,27 (25°C) [Лит.]
этилацетат: не растворим [Лит.]
этиленгликоль: 15,85 (30°C) [Лит.]
этилендиамин: 0,78 (25°C) [Лит.]
Плотность:
2,75 (25°C, г/см3, состояние вещества - кристаллы)
Вкус, запах, гигроскопичность:
вкус: соленый
запах: без запаха
Способы получения:
- Реакцией брома с щелочным раствором формиата калия. [Лит.]
- Реакцией карбоната калия с бромидом железа(II) при нагревании. [Лит.]
- Реакцией брома, гидроксида калия и раствора аммиака. [Лит.]
- Реакцией бромида кальция с сульфатом калия. [Лит.]
Реакции вещества:
- Бромоформ может быть получен электрохимическим бромированием ацетона с водным раствором бромида калия. Выход 65%. [Лит.1
 ]
]
CH3COCH3 + 3KBr + 3H2O → CHBr3 + CH3COOK + 2KOH + 3H2
- Азеотроп бромоводорода с водой можно получить отгонкой из холодной смеси бромида калия, воды и серной кислоты после фильтрования сульфата калия. [Лит.1
 ]
]
2KBr + H2SO4 → 2HBr + K2SO4
Свойства растворов:
30% (вес.), растворитель - вода
Динамическая вязкость (мПа·с) = 0,952 (20°)
Плотность (г/см3) = 1,2593 (20°)
Показатель преломления для D-линии натрия = 1,3743 (20°)
Температура замерзания (°C) = -11,82
40% (вес.), растворитель - вода
Относительная плотность к плотности воды при 4°C = 1,3746 (20°)
Дипольный момент молекулы (в дебаях):
9,1 (647°C)
Динамическая вязкость жидкостей и газов (в мПа·с):
1,18 (747°C)
0,92 (847°C)
0,83 (907°C)
Поверхностное натяжение (в мН/м):
88,2 (750°C)
81 (850°C)
73,8 (950°C)
Скорость звука в веществе (в м/с):
1770 (742°C, состояние среды - жидкость)
3550 (20°C, состояние среды - кристаллы, ось L100)
1360 (20°C, состояние среды - кристаллы, ось S100)
3020 (20°C, состояние среды - кристаллы, ось L110)
Стандартная энтальпия образования ΔH (298 К, кДж/моль):
-180 (г)Стандартная энтропия вещества S (298 К, Дж/(моль·K)):
250,42 (г)Стандартная мольная теплоемкость Cp (298 К, Дж/(моль·K)):
36,93 (г)Стандартная энтальпия образования ΔH (298 К, кДж/моль)
-393,8 (т) [Лит.]
Стандартная энергия Гиббса образования ΔG (298 К, кДж/моль)
-380,7 (т) [Лит.]
Стандартная энтропия S (298 К, Дж/(моль·K))
95,9 (т) [Лит.]
Стандартная мольная теплоемкость Cp (298 К, Дж/(моль·K))
52,3 (т) [Лит.]
Энтальпия плавления ΔHпл (кДж/моль)
25,52 (т) [Лит.]
Источники информации:
- Seidell A. Solubilities of inorganic and metal organic compounds. - 3ed., vol.1. - New York: D. Van Nostrand Company, 1940. - С. 685-696
- Беликов В.Г. Учебное пособие по фармацевтической химии. - М.: Медицина, 1979. - С. 18
- Лурье Ю.Ю. Справочник по аналитической химии. - М.: Химия, 1971. - С. 91
- Рабинович В.А., Хавин З.Я. Краткий химический справочник. - Л.: Химия, 1977. - С. 68
- Справочник по растворимости. - Т.1, Кн.1. - М.-Л.: ИАН СССР, 1961. - С. 685-688, 738-739
- Справочник химика. - Т. 2. - Л.-М.: Химия, 1964. - С. 80-81
- Физические величины. - Под ред. Григорьева И.С., Мейлихова Е.З. - М.: Энергоатомиздат, 1991. - С. 141
Если не нашли нужное вещество или свойства можно выполнить следующие действия:
Если вы нашли ошибку на странице, выделите ее и нажмите Ctrl + Enter.
© Сбор и оформление информации: Руслан Анатольевич Кипер