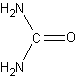Главная страница
 Базы данных
Базы данных
 База данных свойств веществ (поиск)
База данных свойств веществ (поиск)
Свойства вещества:
мочевина
Синонимы и иностранные названия:
urea (англ.)
карбамид (рус.)
угольной кислоты диамид (рус.)
Тип вещества:
органическое
Внешний вид:
бесцветн. тетраэдрические кристаллы (растворитель перекристаллизации - вода)Брутто-формула (по системе Хилла для органических веществ):
CH4N2OФормула в виде текста:
H2NCONH2Молекулярная масса (в а.е.м.): 60,055
CAS №: 57-13-6
Температура плавления (в °C):
132,7Температурные константы смесей (содержание в весовых процентах):
-14 °C (температура плавления эвтектической смеси) ацетилхолина хлорид 60,2% мочевина 39,8%
-11,5 °C (температура плавления эвтектической смеси) вода 67,5% мочевина 32,5%
12 °C (температура плавления эвтектической смеси) 2-гидрокси-N,N,N-триметилэтанаминия хлорид 54% мочевина 46%
84 °C (температура плавления эвтектической смеси) мочевина 73% натрия нитрат 27%
98 °C (температура плавления эвтектической смеси) аммония карбамат 51% мочевина 49%
110 °C (температура плавления эвтектической смеси) калия нитрат 16% мочевина 84%
Растворимость (в г/100 г растворителя или характеристика):
1,1,2-трифтор-1,2,2-трихлорэтан: мало растворим [Лит.]
1-октанол: 0,6 (20°C) [Лит.]
акриловая кислота 70,91% водная: 97,043 (35°C) [Лит.]
акриловая кислота 70,91% водная: 119,7 (50°C) [Лит.]
акриловая кислота 70,91% водная: 172,32 (70°C) [Лит.]
аллиловый спирт: 9,37 (19,4°C) [Лит.]
аммиак жидкий: 25,1 (-26,6°C) [Лит.]
аммиак жидкий: 63,52 (5,8°C) [Лит.]
аммиак жидкий: 107,6 (23,9°C) [Лит.]
бензол: плохо растворим [Лит.]
вода: смешивается [Лит.]
вода: 67 (0°C) [Лит.]
вода: 84 (10°C) [Лит.]
вода: 104,7 (20°C) [Лит.]
вода: 136 (30°C) [Лит.]
вода: 165,4 (39,7°C) [Лит.]
вода: 205 (50°C) [Лит.]
вода: 206,4 (50,6°C) [Лит.]
вода: 246 (60°C) [Лит.]
вода: 295 (68,5°C) [Лит.]
вода: 314,6 (70°C) [Лит.]
вода: 400 (80°C) [Лит.]
вода: 525 (90°C) [Лит.]
вода: 733 (100°C) [Лит.]
вода: 2122 (120°C) [Лит.]
глицерин: 50 (15°C) [Лит.]
глицерин 74,72%: 69,58 (35°C) [Лит.]
глицерин 74,72%: 93,37 (50°C) [Лит.]
глицерин 74,72%: 110,35 (60°C) [Лит.]
глицерин 74,72%: 145,77 (70°C) [Лит.]
диоксид серы: растворим [Лит.]
диэтиловый эфир: 0,00056 (20°C) [Лит.]
изоамиловый спирт: 0,7 (10°C) [Лит.]
изоамиловый спирт: 1,2 (20°C) [Лит.]
изоамиловый спирт: 1,6 (30°C) [Лит.]
изоамиловый спирт: 2,1 (40°C) [Лит.]
изоамиловый спирт: 5,5 (90°C) [Лит.]
изобутанол: 6,2 (20°C) [Лит.]
изопропанол: 2,6 (20°C) [Лит.]
метанол: 3,48 (-18,1°C) [Лит.]
метанол: 15 (0°C) [Лит.]
метанол: 22 (20°C) [Лит.]
метанол: 62,8 (60°C) [Лит.]
пиридин: 0,96 (25°C) [Лит.]
пиридин 50% водный: 21,53 (20°C) [Лит.]
пропанол: 1,65 (0°C) [Лит.]
пропанол: 2 (10°C) [Лит.]
пропанол: 2,56 (20°C) [Лит.]
пропанол: 3,6 (30°C) [Лит.]
пропанол: 4,8 (40°C) [Лит.]
пропанол: 6,2 (50°C) [Лит.]
пропанол: 7,7 (60°C) [Лит.]
пропанол: 9,8 (70°C) [Лит.]
пропанол: 12,3 (80°C) [Лит.]
пропанол: 17 (90°C) [Лит.]
пропанол: 18,06 (98°C) [Лит.]
фтороводород: легко растворим [Лит.]
хлороформ: не растворим [Лит.]
этанол: 2,6 (0°C) [Лит.]
этанол: 4 (10°C) [Лит.]
этанол: 5,4 (20°C) [Лит.]
этанол: 6,73 (20°C) [Лит.]
этанол: 6,2 (25°C) [Лит.]
этанол: 7,2 (30°C) [Лит.]
этанол: 9,3 (40°C) [Лит.]
этанол: 9,16 (40°C) [Лит.]
этанол: 11,7 (50°C) [Лит.]
этанол: 15,1 (60°C) [Лит.]
этанол: 20,2 (70°C) [Лит.]
этилацетат: 0,08 (25°C) [Лит.]
этиленгликоль: 44 (25°C) [Лит.]
Фазовая и многокомпонентная растворимость (в масс%):
вода 43,1%, кальция сульфат 1,1%, мочевина 55,8%, 25 °C, отделяющаяся фаза: (NH2)2CO + CaSO4 * 4(NH2)2CO [Лит.]
вода 47,1%, кальция сульфат 1,4%, мочевина 51,5%, 25 °C, отделяющаяся фаза: CaSO4 * 2H2O + CaSO4 * 4(NH2)2CO [Лит.]
Плотность:
1,33 (25°C, г/см3, состояние вещества - кристаллы)
Вкус, запах, гигроскопичность:
запах: без запаха
Некоторые числовые свойства вещества:
Гигроскопическая точка (% относительной влажности): 75,6 (25 С)
Год открытия: 1773 (Руэль И. мл.)
Год химического синтеза: 1828 (Вёлер Ф.)
Минимальная концентрация определения горького вкуса (ммоль/л): 100
Объем производства (тонн/год): 106000000 (в мире, 1984 год)
Объем производства (тонн/год): 230000 (в мире, без СССР, 1950 г.)
Объем производства (тонн/год): 3185000 (в мире, без СССР, 1962 г.)
Метод очистки или выделения из смесей 1:
Источник информации: Гаттерман Л., Виланд Г. Практические работы по органической химии. - 5-е изд. - М.-Л.: ГНТИХЛ, 1948 стр. 177-178Выпаривают 2 л мочи в фарфоровой чашке на водяной бане до консистенции сиропа, который еще в горячем состоянии обрабатывают 500 мл спирта (погасить горелки!). После некоторого стояния прозрачную вытяжку сливают, остаток вновь нагревают и вновь таким же образом обрабатывают 500 мл спирта.
Обе вытяжки соединяют (в случае надобности их предварительно фильтруют), отгоняют спирт и упаривают досуха водно-спиртовой остаток в маленькой фарфоровой чашке на водяной бане. Чашку сильно охлаждают снаружи и добавляют к ее содержимому (при охлаждении и энергичном перемешивании) двойной объем бесцветной концентрированной азотной кислоты.
После 12-часового стояния кашеобразную массу азотнокислой мочевины тщательно отсасывают, промывают небольшим количеством охлажденной льдом азотной кислоты (1:1) и снова отсасывают.
Отфильтрованный осадок размешивают при нагревании со 100—150 мл воды и нейтрализуют, постепенно прибавляя углекислый барий; следует избегать избытка последнего.
Когда жидкость будет нейтрализована, ее кипятят с небольшим количеством животного угля, отсасывают горячий раствор, промывают животный уголь один раз горячей водой и выпаривают фильтрат досуха. Из остатка мочевину извлекают горячим спиртом, в котором она легко растворима; при концентрировании спиртового раствора мочевина выделяется в кристаллическом виде.
Выход 20—25 г.
Способы получения:
- Реакцией фосгена с аммиаком (метод Сименса). [Лит.]
- Гидролизом цианамида. [Лит.]
- Реакцией аммиака с углекислым газом (реакция Базарова). [Лит.]
Используется для синтеза веществ:
мочевина - водорода пероксид (1/1)
Реакции вещества:
- При нагревании выше 150 С образуются циануровая кислота и аммелид. [Лит.]
- При медленном нагревании мочевины выше температуры ее плавления при атмосферном давлении выделяется аммиак и образуется биурет. [Лит.]
- С ангидридами ароматических дикарбоновых кислот дает имиды; например, с фталевым ангидридом при 150 С образуется фталимид. (выход 90%) [Лит.]
- Реагирует с дигидрофосфатом кальция в твердом виде и в водных растворах с образованием фосфата мочевины и гидрофосфата кальция. [Лит.]
- С перекисью водорода на холоду дает комплексное соединение мочевина - пероксид водорода (1/1) CO(NH2)2 · H2O2. [Лит.]
- Алкилируется иодметаном сначала до N-метилмочевниы, затем до N.N'-диметилмочевины. [Лит.]
- С азотной кислотой образует нитрат мочевины. [Лит.]
- Гидролизуется водными растворами кислот и щелочей. [Лит.]
- С фосфорной кислотой образует фосфат мочевины (1/1). [Лит.]
- Гидролизуется водным раствором гидроксида бария с образованием цианата бария, карбоната бария, аммиака и углекислого газа. [Лит.]
- Реагирует с азотистой кислотой с образованием азота и углекислого газа. [Лит.]
- При нагревании выше 150 С с аммиаком в замкнутом объеме, под давлением образует меламин. [Лит.]
- Со многими солями дает комплексные соединения, например NH4NO3 · CO(NH2)2, 2NH4NO3 · CO(NH2)2, NaCl · CO(NH2)2 · H2O, Ca(NO3)2 · 4CO(NH2)2, CaSO4 · 4CO(NH2)2. [Лит.]
- При действии спиртов образует уретаны. [Лит.]
- С бромом дает циануровую кислоту. [Лит.]
- С гипохлоритом натрия дает гидразин. [Лит.]
- Алкилируется с образованием алкилмочевин. [Лит.]
- С анилином дает фенил- и дифенилмочевины. [Лит.]
- С двухосновными карбоновыми кислотами образует циклические уреиды. [Лит.]
- При 140 С с уксусным ангидридом дает смесь ацетамида и диацетамида. [Лит.]
- При сплавлении с содой дает цианат натрия, углекислый газ, аммиак и воду. [Лит.]
- Реагирует с концентрированным олеумом с образованием сульфаминовой кислоты. [Лит.]
- При 110 С с сероуглеродом образует тиоцианат аммония и оксид-сульфид углерода. [Лит.]
- С гидразином дает семикарбазид и диамид гидразин-1,2-дикарбоновой кислоты. [Лит.]
- При сплавлении с нитратом аммония в присутствии оксида кремния образует гуанидин. [Лит.]
- Легко конденсируется с формальдегидом с образованием мочевино-формальдегидных смол. [Лит.]
- При 60 С с уксусным ангидридом в присутствии серной кислоты образует ацетилмочевину. [Лит.]
- В расплавленном виде реагирует с щелочными металлами и их амидами с образованием солей цианамида. [Лит.]
- При взаимодействии с карбоновыми кислотами, их ангидридами, хлорангидридами или сложными эфирами образует уреиды карбоновых кислот. [Лит.]
- При нагревании с хлоридом цинка образует циануровую кислоту. [Лит.]
- При нагревании с металлическим натрием дает цианамид. [Лит.]
- Реагирует с хлором на холоду с образованием N-хлор и N,N'-дихлормочевины. [Лит.]
- Нагревание мочевины с гидрохлоридом метиламина при 160-170 С дает N,N'-диметилмочевину. [Лит.]
- Реагирует с малоновой кислотой в присутствии хлорокиси фосфора с образованием барбитуровой кислоты. [Лит.]
- Реагирует с первичными аминами с образованием N,N'-диалкилмочевин. [Лит.]
- При нагревании с эквимолекулярным количеством хлористого сульфурила или хлорсульфоновой кислоты дает циануровую кислоту. [Лит.]
- Реагирует с трет-бутанолом в присутствии серной кислоты с образованием N-трет-бутилмочевины. (выход 31%) [Лит.]
- Реагирует с бромом при 0-5 С в воде в присутствии карбоната кальция с образованием N-броммочевины. [Лит.]
- Реагирует с трет-бутилгипохлоритом в присутствии хлорида кальция с образованием N-хлормочевины. [Лит.]
- Количественно гидролизуется концентрированной серной кислотой. (выход 100%) [Лит.]
- Под действием фермента уреазы, который присутствует во многих организмах и семенах растений, гидролизуется количественно. (выход 100%) [Лит.]
- Образует соль с щавелевой кислотой. [Лит.]
- С натриймалоновым эфиром в спиртовом растворе образует барбитуровую кислоту. [Лит.]
- При пропускании сухого хлора через расплавленную мочевину образуется циануровая кислота. Выход 68%. [Лит.1]
24(NH2)2CO + 9Cl2 → 18NH4Cl + 3N2 + 8(CONH)3
- Цианамид получают нагреванием мочевины с металлическим натрием. [Лит.1]
CO(NH2)2 + Na → NaOH + H2NCN
- Мочевина реагирует при 130 C в присутствии катализаторов (сульфата цинка, сульфата магния и др.) с глицерином с образованием глицеринкарбоната. Без катализатора выход 41% при 140 С. Выход 81% (с сульфатом цинка). [Лит.1, Лит.2]
- Циануровая кислота может быть получена нагреванием мочевины с эквимолекулярным количеством сульфурилхлорида или хлорсульфоновой кислоты. [Лит.1]
Реакции, в которых вещество не участвует:
- Не окисляется перманганатом калия. [Лит.]
- В водном растворе не реагирует с перекисью водорода даже при температуре кипения раствора. [Лит.]
- Wada был предложен метод декарбоксилирования аминокислот в котором при нагревании мочевины или цианата калия с аминокислотами в щелочном или нейтральном растворе образуются урамидокислоты, которые при действии разбавленных кислот превращаются в гидантоины, которые при действии кислот или щелочей распадаются в амины. Метод не удалось воспроизвести другим авторам. [Лит.1]
Показатель преломления (для D-линии натрия):
1,4840 (20°C)
Свойства растворов:
10% (вес.), растворитель - вода
Плотность (г/см3) = 1,0255 (20°)
Температура кипения (°C) = 100,8
20% (вес.), растворитель - вода
Динамическая вязкость (мПа·с) = 1,185 (20°)
Плотность (г/см3) = 1,052 (20°)
Температура кипения (°C) = 102,2
30% (вес.), растворитель - вода
Плотность (г/см3) = 1,081 (20°)
Температура кипения (°C) = 103,7
40% (вес.), растворитель - вода
Плотность (г/см3) = 1,1085 (20°)
Температура кипения (°C) = 105,4
44% (вес.), растворитель - вода
Динамическая вязкость (мПа·с) = 1,7 (20°)
Плотность (г/см3) = 1,1239 (20°)
Показатель преломления для D-линии натрия = 1,4018 (20°)
Температура замерзания (°C) = -17,62
Показатели диссоциации:
pKBH+ (1) = 0,1 (21°C, вода)
Стандартная энтальпия образования ΔH (298 К, кДж/моль):
-333,3 (т)Стандартная энергия Гиббса образования ΔG (298 К, кДж/моль):
-197,3 (т)Стандартная энтропия вещества S (298 К, Дж/(моль·K)):
104,67 (т)Стандартная мольная теплоемкость Cp (298 К, Дж/(моль·K)):
93,198 (т)Некоторые нечисловые свойства вещества:
гигроскопичен
Разные дозы:
ЛД0 (белые крысы, через рот) = 12 000 мг/кг.
Информация из сети Интернет или других непостоянных источников:
Практически нерастворима в хлористом метилене. [https://www.finarchemicals.com/product-detail/98920SK025/urea-pheur]
Анализ вещества:
Дает малорастворимые или нерастворимые осадки CO(NH2)2·HNO3, CO(NH2)2·H2C2O4, 2CO(NH2)2·Hg(NO3)2·HgO (при обработке нитратом ртути).
С ксантгидролом из уксуснокислого раствора дает малорастворимый осадок диксантилмочевины (чувствительность весового определения 0,4 мкг).
История:
Открыта в моче И. Руэллем в 1773 году. Впервые синтезирована Ф. Вёлером в 1828 году из цианата аммония, что нанесло первый удар по витализму - учению о жизненной силе.
Применение вещества:
- азотсодержащее удобрение [Лит.]
- для получения мочевино-формальдегидных смол [Лит.]
- для разделения нефтепродуктов [Лит.]
- для синтеза гидразина [Лит.]
- для синтеза лекарственных средств (бромурал, веронал) [Лит.]
- добавка к кормам жвачных животных (заменяет белковые вещества) [Лит.]
Дополнительная информация:
Кристаллы обладают пьезоэлектрическими свойствами.
Повышает растворимость некоторых веществ.
Источники информации:
- Seidell A. Solubilities of organic compounds. - 3ed., vol.2. - New York: D. Van Nostrand Company, 1941. - С. 55-62
- Yalkowsky S.H., Yan H. Handbook of aqueous solubility data. - CRC Press, 2003. - С. 10
- Вирпша З., Бжезиньский Я. Аминопласты. - М.: Химия, 1973. - С. 13-18
- Вредные вещества в промышленности: Справочник для химиков, инженеров и врачей. - 7-е изд., Т.2. - Л.: Химия, 1976. - С. 48
- Гордон А., Форд Р. Спутник химика. - М.: Мир, 1976. - С. 73
- Горловский Д.М., Альтшулер Л.Н., Кучерявый В.И. Технология карбамида. - Л.: Химия, 1981
- Зотов А.Т. Мочевина. - М.: ГНТИХЛ, 1963
- Каррер П. Курс органической химии. - Л.: ГНТИХЛ, 1960. - С. 2
- Краткая химическая энциклопедия. - Т. 3: Мальтаза-Пиролиз. - М.: Советская энциклопедия, 1964. - С. 328-331
- Некрасов Б.В. Основы общей химии. - Т.1. - М.: Химия, 1973. - С. 510
- Позин М.Е. Технология минеральных солей (удобрений, пестицидов, промышленных солей, окислов и кислот). - Ч.2. - Л.: Химия, 1974. - С. 1282-1302
- Справочник азотчика. - М.: Химия, 1987. - С. 247-288
- Справочник по растворимости. - Т.1, Кн.1. - М.-Л.: ИАН СССР, 1961. - С. 374-375
- Справочник по растворимости. - Т.1, Кн.2. - М.-Л.: ИАН СССР, 1962. - С. 1132-1133, 1154-1158
- Справочник химика. - Т. 2. - Л.-М.: Химия, 1964. - С. 800-801
- Успехи химии. - 1965. - Т.34, №12. - С. 2124-2143 (двойные и тройные системы)
- Хёрд Ч.Д. Пиролиз соединений углерода. - Л.-М.: ГОНТИ РКТП СССР, 1938. - С. 599-600
- Химическая энциклопедия. - Т. 3. - М.: Советская энциклопедия, 1992. - С. 144-145
Если не нашли нужное вещество или свойства можно выполнить следующие действия:
Если вы нашли ошибку на странице, выделите ее и нажмите Ctrl + Enter.
© Сбор и оформление информации: Руслан Анатольевич Кипер