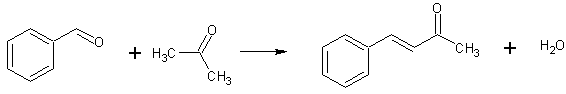

В стакане, снабженном мешалкой и термометром, смешивают 20 мл ацетона, 10 мл бензальдегида и 10 мл воды. Стакан с содержимым помещают в водяную баню и при температуре смеси 25... 30°С постепенно приливают из капельной воронки 2,5 мл 10%-ного раствора гидроксида натрия. Смесь перемешивают при комнатной температуре 2 ч. После окончания конденсации к реакционной массе приливают разбавленную соляную кислоту до кислой реакции на лакмус и смесь переливают в делительную воронку. Верхний слой — желтую маслянистую жидкость — отделяют от нижнего водного слоя, который снова переливают в делительную воронку и экстрагируют 8 мл бензола. Бензольный.раствор соединяют с желтой маслянистой жидкостью, промывают 5 мл воды и отделяют водный слой.
Смесь органических веществ помещают в колбу Вюрца и на водяной бане отгоняют бензол, а бензальацетон перегоняют в вакууме. Собирают фракцию ст. кип. 148... 160° (при 3,3 кПа или 25 мм рт. ст.), имеющую светло-желтый оттенок. При стоянии бензальацетон кристаллизуется.
Выход 10 г (70% от теоретического).
Бензальацетон (4-фенил-3-бутен-2-он, бензилиденацетон, метилстирилкетон, метилциннамилкетон) — бесцветные пластинки с т. пл. 42°С, т. кип. 260... 262°С. Легко растворим в этиловом спирте, растворим в диэтиловом эфире, хлороформе, бензоле, не растворяется в воде.
УФ-Спектр (в этаноле) [λmax (lg e)]: 284 нм (4,37), 222 (4,08).

В 2-литровой склянке, снабженной механической мешалкой, смешивают 635 г (800 мл; 11,0 мол.) х.ч. ацетона (примечания 1 и 2), 420 г (400 мл; 4,0 мол.) свежеперегнанного бензальдегида с т. кип. 178—180°, промытого непосредственно перед первой и второй перегонкой разбавленным раствором соды, и 400 мл воды. К этой смеси медленно прибавляют из капельной воронки (примечание 3) 100 мл 10%-ного водного раствора едкого натра. Смешение производят при охлаждении в водяной бане и при перемешивании. Щелочь прибавляют постепенно таким образом, чтобы температура смеси поддерживалась между 25 и 31 С. Это требует от 0,5 до 1 часа. После прибавления всей щелочи смесь размешивают 2 часа 15 мин при комнатной температуре (примечание 4). По истечении этого времени к реакционной массе прибавляют разбавленной соляной кислоты до кислой реакции на лакмус. Два образовавшихся слоя разделяют в делительной воронке. Нижний, водный слой экстрагируют 100 мл бензола и бензольный раствор прибавляют к желтому маслу — верхнему слою, полученному при первом разделении. Бензольный раствор взбалтывают с 100 мл воды и отделяют.
Бензол отгоняют на водяной бане, остаток перегоняют в вакууме (примечание 5). Начальный погон содержит незначительное количество воды, которую затем отделяют (примечание 6). Для перегонки удобно применять колбу с дефлегматором. Фракция, которая перегоняется при 148—160°(25 мм), 133—143°(16 мм) или при 120—130°(7 мм), составляет 430—470 г. При стоянии она затвердевает в кристаллическую массу; полученный продукт достаточно чист для большинства работ. После вторичной перегонки получают 375—450 г (65—78% теоретич.) продукта, кипящего при 137—142°(16 мм) или при 123—128°/8 мм; он также затвердевает при стоянии в кристаллы с т. пл. 40—42° (примечание 7).
Примечания
1. Бензальацетон сильно раздражает кожу; поэтому при работе с ним необходимо соблюдать осторожность.
2. Значительный избыток ацетона применяют для уменьшения образования дибензальацетона.
3. Если едкий натр прибавлен слишком быстро, и без достаточного охлаждения, смесь темнеет и выход уменьшается. Скорость прибавления лучше всего регулировать путем наблюдения за температурой реакционной смеси.
4. Вместо размешивания смеси, после прибавления едкого натра склянку можно тщательно закупорить и встряхивать на качалке в течение того же промежутка времени.
5. Чем меньше давление при перегонке в вакууме, тем меньше разложение и тем меньше остаток в перегонной колбе. Этот остаток содержит некоторое количество дибензальацетона.
6. Первые несколько миллилитров дестиллята имеют зеленоватый оттенок, но остальной продукт — светло-желтого цвета. Если начальный погон собрать отдельно, то остальная часть перегнанного продукта будет только слабо окрашена.
7. Под действием воздуха бензальацетон постепенно делается коричневым, особенно, если он недостаточно чист. Чистый продукт может сохраняться месяцами в обыкновенной закупоренной банке без изменения окраски.
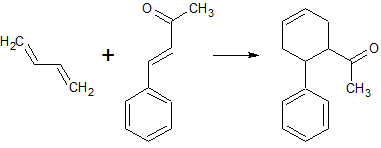
Перегоняется с паром.
Реакция бензальацетона с перекисью водорода в едком натре дает эпоксид стирилового эфира уксусной кислоты этого эфира с выходом 70%.
Восстанавливается различными восстановителями (цинковой пылью в уксусной кислоте, амальгамой натрия в уксусной кислоте, водородом над палладием и др.) до бензилацетона, при этом побочно образуется продукт димеризации 4,5-дифенилоктандион-2,7; при использовании амальгамы алюминия димерный продукт становится основным (выход 20%).
Реагирует со смесью водорода и аммиака при 150 С, 8 МПа над никелевым катализатором давая с 84%-ным выходом 2-амино-4-фенилбутан.