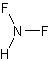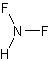Главная страница
 Базы данных
Базы данных
 База данных свойств веществ (поиск)
База данных свойств веществ (поиск)
Свойства вещества:
дифторамин
Синонимы и иностранные названия:
difluoramine (англ.)
Тип вещества:
неорганическое
Внешний вид:
бесцветн. газКристаллические модификации, структура молекулы, цвет растворов и паров:
В жидком виде бесцветен.
Брутто-формула (по системе Хилла для органических веществ):
HF2NФормула в виде текста:
NHF2Молекулярная масса (в а.е.м.): 53,01
Температура плавления (в °C):
-116,8Температура кипения (в °C):
-23,3Температура разложения (в °C):
20Растворимость (в г/100 г растворителя или характеристика):
вода: растворим [Лит.]
диэтиловый эфир: растворим [Лит.]
серная кислота: мало растворим [Лит.]
Плотность:
1,587 (-80,5°C, г/см3, состояние вещества - жидкость)
1,378 (-23,6°C, г/см3, состояние вещества - жидкость)
Вкус, запах, гигроскопичность:
запах: окислов азота
Некоторые числовые свойства вещества:
Год открытия: 1958 (Кеннеди, Колберн)
Метод получения 1:
Источник информации: Руководство по неорганическому синтезу. - Т.1, под ред. Брауэра Г. - М.: Мир, 1985 стр. 222В литровую круглодонную колбу, снабженную магнитной мешалкой и присоединенную к вакуумной установке, наливают 12 мл тиофенола. После обезгаживания тиофенола колбу охлаждают жидким азотом и конденсируют в нее 483 мл газообразного N2F4. Затем смесь приводят к комнатной температуре и помещают реакционную колбу в масляную баню. При перемешивании смесь выдерживают 4 ч при 50°С. Убирают масляную баню и охлаждают реакционную смесь.
Содержимое реакционной колбы отгоняют в вакууме, конденсируя фракции при —80, —128 и —196 °С. Продукт, собранный во второй ловушке, затем вновь перегоняют и конденсируют в приемник при —196°С. Этот конденсат содержит 99% NHF2. Получают 587 мл газа, что соответствует выходу 75%. В ловушке, охлаждаемой при —196°С, собирается не вступивший в реакцию N2F4.
Дифторамин в виде газа можно хранить в сосудах из стекла пирекс при комнатной температуре. В не очень чистых металлических сосудах он постепенно разлагается. Внимание! Дифторамин иногда имеет склонность к чрезвычайно сильным взрывам. Это может касаться также ловушек в вакуумной системе, если они отогреваются или в них попал воздух.
Способы получения:
- Получают взаимодействием фтора с водными растворами мочевины или сульфамидами. (выход 30%) [Лит.]
- Реакцией тетрафторгидразина с арсином в автоклаве в течение 1 часа при 50-60 С. (выход 52%) [Лит.]
- Реакцией тетрафторгидразина с тиофенолом в стеклянном реакторе при 50 С. (выход 75%) [Лит.]
- Нагреванием смеси тетрафторгидразина с ацетальдегидом до 150 С. [Лит.]
- Дифторамин получают гидролизом подкисленных растворов N,N-дифтормочевины при 50-60 С. [Лит.1]
H2NCONF2 + H2O + H2SO4 → HNF2 + CO2 + NH4HSO4
Дипольный момент молекулы (в дебаях):
1,93 (20°C)
Стандартная энтропия вещества S (298 К, Дж/(моль·K)):
252,8 (г)Стандартная мольная теплоемкость Cp (298 К, Дж/(моль·K)):
43,4 (г)Дополнительная информация::
В жидком и твердом состоянии взрывается при нагревании.
Окисляет количественно иодиды до иода. Дезаминирует амины до алканов; трет-бутиламин дезаминируется в изобутилен.
Источники информации:
- CRC Handbook of Chemistry and Physics. - 90ed. - CRC Press, 2010. - С. 5-11
- Chemical Reviews. - 1962. - Vol. 62, No. 1. - С. 6-7
- Некрасов Б.В. Основы общей химии. - Т.1. - М.: Химия, 1973. - С. 402
- Успехи химии фтора. - Т. 3-4. - Л.: Химия, 1970. - С. 25-27
- Успехи химии. - 1963. - Т.32, №3. - С. 346-348
- Успехи химии. - 1963. - Т.32, №8. - С. 992-993
- Успехи химии. - 1966. - Т.35, №11. - С. 1897-1921
- Химический энциклопедический словарь. - Под ред. Кнунянц И.Л. - М.: Советская энциклопедия, 1983. - С. 186
Если не нашли нужное вещество или свойства можно выполнить следующие действия:
Если вы нашли ошибку на странице, выделите ее и нажмите Ctrl + Enter.
© Сбор и оформление информации: Руслан Анатольевич Кипер