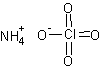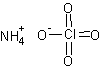Главная страница
 Базы данных
Базы данных
 База данных свойств веществ (поиск)
База данных свойств веществ (поиск)
Свойства вещества:
аммония перхлорат
Синонимы и иностранные названия:
ammonium perchlorate (англ.)
Название вещества с нормальным (не справочным) порядком слов русского языка:
перхлорат аммонияТип вещества:
неорганическое
Внешний вид:
бесцветн. ромбические кристаллыБрутто-формула (по системе Хилла для органических веществ):
H4ClNO4Формула в виде текста:
NH4ClO4Молекулярная масса (в а.е.м.): 117,489
Температура разложения (в °C):
270Температуры полиморфных переходов (в °C):
ромбические крист. в кубические крист. = 238°C, ΔHперехода = 9 кДж/моль
Растворимость (в г/100 г растворителя или характеристика):
1-бутанол: 0,017 (25°C) [Лит.]
аммиак жидкий: 135 (25°C) [Лит.]
ацетон: 2,26 (25°C) [Лит.]
вода: 10,7 (0°C) [Лит.]
вода: 20,2 (25°C) [Лит.]
вода: 42,5 (85°C) [Лит.]
диоксид серы: 0,025 (0°C) [Лит.]
диэтиловый эфир: не растворим [Лит.]
изобутанол: 0,1272 (25°C) [Лит.]
метанол: 6,85 (25°C) [Лит.]
пропанол: 0,3865 (25°C) [Лит.]
серная кислота: сольволиз [Лит.]
этанол: 1,906 (25°C) [Лит.]
этилацетат: 0,029 (25°C) [Лит.]
Плотность:
1,95 (20°C, г/см3, состояние вещества - кристаллы)
Реакции вещества:
- Термический распад до хлора, оксида азота(I), кислорода и воды в диапазоне температур 150-300 С идет автокаталитически и прекращается после распада примерно 30% вещества из-за перехода в другую кристаллическую форму. Выше 300 С распад до хлора, оксида азота(II), кислорода и воды идет до конца. [Лит.]
4NH4ClO4 → 2Cl2 + 2N2O + 3O2 + 8H2O (150-300°C)
2NH4ClO4 → Cl2 + 2NO + O2 + 4H2O (>300°C)
Стандартная энтальпия образования ΔH (298 К, кДж/моль):
-295,3 (т)Стандартная энергия Гиббса образования ΔG (298 К, кДж/моль):
-88,8 (т)Стандартная энтропия вещества S (298 К, Дж/(моль·K)):
186,2 (т)Дополнительная информация::
Взрывается при ударе и трении, в присутствии окисляющихся веществ.
Мировое производство около 100 000 т/год (без СССР).
Источники информации:
- CRC Handbook of Chemistry and Physics. - 95ed. - CRC Press, 2014. - С. 4-47
- Dean J.A. Lange's handbook of chemistry. - 1999. - С. 3.16
- Journal of the American Chemical Society. - 1923. - Vol. 45, No. 2. - С. 294 (растворимость)
- Perry D.L. Handbook of Inorganic Compounds. - 2nd ed. - CRC Press, 2011. - С. 30-31
- Seidell A. Solubilities of inorganic and metal organic compounds. - 3ed., vol.1. - New York: D. Van Nostrand Company, 1940. - С. 1094-1096
- Urbanski T. Chemistry and technology of explosives. - vol.2. - Warszawa, 1965. - С. 477-483
- Гринвуд Н., Эрншо А. Химия элементов. - Т.2. - М.: БИНОМ. Лаборатория знаний, 2008. - С. 212
- Ефимов А.И. и др. Свойства неорганических соединений. Справочник. - Л.: Химия, 1983. - С. 98-99
- Иванов В.М., Семененко К.А., Прохорова Г.В., Симонов Е.Ф. Натрий. - М.: Наука, 1986. - С. 19 (растворимость)
- Справочник по растворимости. - Т.1, Кн.1. - М.-Л.: ИАН СССР, 1961. - С. 214-215, 743-744
- Химическая энциклопедия. - Т. 1. - М.: Советская энциклопедия, 1988. - С. 154
- Химический энциклопедический словарь. - Под ред. Кнунянц И.Л. - М.: Советская энциклопедия, 1983. - С. 43
- Якименко Л.М. Производство хлора, каустической соды и неорганических хлорпродуктов. - М.: Химия, 1974. - С. 433-434, 448-453
- Якименко Л.М., Серышев Г.А. Электрохимический синтез неорганических соединений. - М.: Химия, 1984. - С. 79-81
Если не нашли нужное вещество или свойства можно выполнить следующие действия:
Если вы нашли ошибку на странице, выделите ее и нажмите Ctrl + Enter.
© Сбор и оформление информации: Руслан Анатольевич Кипер