Главная страница
 Базы данных
Базы данных
 База данных свойств веществ (поиск)
База данных свойств веществ (поиск)
Свойства вещества:
хлоруксусная кислота α-форма
Синонимы и иностранные названия:
chloroacetic acid (англ.)
монохлоруксусная кислота (α-форма) (рус.)
хлорэтановая кислота α-форма (рус.)
Тип вещества:
органическое
Внешний вид:
бесцветн. моноклинные кристаллыКристаллические модификации, структура молекулы, цвет растворов и паров:
Существует в 4 модификациях - альфа (моноклинная, параметры решетки: a=0,538 нм, b=1,927 нм, c=0,801 нм, β=109,5°, z=8, пространственная группа P21/c), бета, гамма, дельта.
Брутто-формула (по системе Хилла для органических веществ):
C2H3ClO2Формула в виде текста:
ClCH2COOHМолекулярная масса (в а.е.м.): 94,49
Температура плавления (в °C):
62,5Температура кипения (в °C):
187,85Растворимость (в г/100 г растворителя или характеристика):
бензол: растворим [Лит.]
вода: 614 (30°C) [Лит.]
вода: 1329 (45°C) [Лит.]
вода: смешивается (62,4°C) [Лит.]
диэтиловый эфир: растворим [Лит.]
сероуглерод: растворим [Лит.]
фтороводород: легко растворим [Лит.]
хлороформ: растворим [Лит.]
этанол: растворим [Лит.]
Плотность:
1,58 (20°C, г/см3, состояние вещества - кристаллы)
1,4043 (40°C, г/см3, состояние вещества - кристаллы)
1,3703 (65°C, г/см3, состояние вещества - жидкость)
Вкус, запах, гигроскопичность:
гигроскопичен
Некоторые числовые свойства вещества:
Минимальная раздражающая концентрация в воздухе (человек, мг/л): 0,0057
Метод получения 1:
Источник информации: Губен И. Методы органической химии. - Т. 3, Вып. 3. - М.: Главная редакция химической литературы, 1935 стр. 337200 г ледяной уксусной кислоты в смеси с 2 г иода, 10 г пятихлористого фосфора и 5 г красного фосфора нагревают до 100 С и в течение 2 часов пропускают хлор, затем сливают с фосфора, разбавляют 50 г ледяной уксусной кислоты, по охлаждении отсасывают монохлоруксусную кислоту и промывают небольшим количеством ледяной уксусной кислоты.
Выход 170 г чистого, с правильной температурой плавления продукта. остаток находится в маточном растворе.
Метод получения 2:
Источник информации: Патент Германии DE157,816 (от 09.07.1903)Нагревают 60 кг уксусной кислоты с 150 кг сульфурилхлорида и 0,6 кг ацетилхлорида до 55-60 С. Уже ниже 50 С начинается хлорирование. Как только выделение газа прекращается, то нагревают еще короткое время до кипения сульфурилхлорида и затем позволяют массе остыть, при этом она полностью закристаллизовывается монохлоруксусной кислотой.
Метод получения 3:
Источник информации: Препаративная органическая химия. - М., 1959 стр. 181-182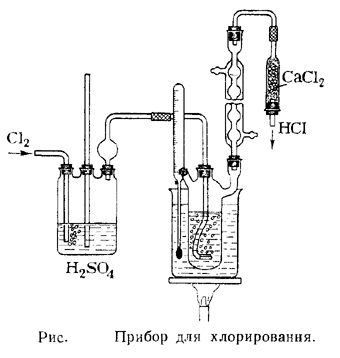 Прибор для хлорирования изображен на рисунке. В трехгорлую колбу емкостью 500 мл помещают смесь 300 г (5 молей) ледяной уксусной кислоты и 15 г (0,14 моля) уксусного ангидрида и нагревают на масляной бане. По достижении температуры 105° начинают постепенно вводить хлор, поддерживая температуру масляной бани в течение всего периода хлорирования в пределах 108— 112°. Через несколько минут после начала введения хлора начинается реакция; желтая (от растворенного хлора) окраска уксусной кислоты исчезает и выделяется хлористый водород. С этого момента следует значительно увеличить скорость пропускания хлора, регулируя, однако, ее таким образом, чтобы из колбы не выходили желтые пары хлора. Хлорирование продолжают около 10 часов (примечание 4). Каждые 2 часа к хлорируемой смеси добавляют по 5 г уксусного ангидрида. Конец хлорирования определяют по значительному уменьшению количества выделяющегося хлористого водорода или путем определения температуры плавления отбираемой пробы. Хлорирование прекращают, когда проба сырой хлоруксусной кислоты будет плавиться при температуре 45—50°. Расплавленный продукт реакции переносят в перегонную колбу и после отгонки небольшого количества предгона собирают фракцию хлоруксусной кислоты, кипящую при температуре 186—188°; при застывании образуются кристаллы с резким запахом. Выход (примечание 5) — 425 г (90% от теоретического).
Прибор для хлорирования изображен на рисунке. В трехгорлую колбу емкостью 500 мл помещают смесь 300 г (5 молей) ледяной уксусной кислоты и 15 г (0,14 моля) уксусного ангидрида и нагревают на масляной бане. По достижении температуры 105° начинают постепенно вводить хлор, поддерживая температуру масляной бани в течение всего периода хлорирования в пределах 108— 112°. Через несколько минут после начала введения хлора начинается реакция; желтая (от растворенного хлора) окраска уксусной кислоты исчезает и выделяется хлористый водород. С этого момента следует значительно увеличить скорость пропускания хлора, регулируя, однако, ее таким образом, чтобы из колбы не выходили желтые пары хлора. Хлорирование продолжают около 10 часов (примечание 4). Каждые 2 часа к хлорируемой смеси добавляют по 5 г уксусного ангидрида. Конец хлорирования определяют по значительному уменьшению количества выделяющегося хлористого водорода или путем определения температуры плавления отбираемой пробы. Хлорирование прекращают, когда проба сырой хлоруксусной кислоты будет плавиться при температуре 45—50°. Расплавленный продукт реакции переносят в перегонную колбу и после отгонки небольшого количества предгона собирают фракцию хлоруксусной кислоты, кипящую при температуре 186—188°; при застывании образуются кристаллы с резким запахом. Выход (примечание 5) — 425 г (90% от теоретического).
Примечания
1. По мере возможности хлорирование следует проводить в приборе на шлифах; можно также применять хорошие корковые пробки; не рекомендуется применять резиновые пробки.
2. Для распыления газа в жидкости применяют барботеры с пористыми пластинками (пластинка № 2). Для проведения хлорирования очень удобна модифицированная (путем припаивания вводной трубки к трубке тубуса для обратного холодильника) склянка Келикера с пористым дном.
3. В качестве масляной бани применяют довольно высокий сосуд емкостью 1 л, наполненный вазелиновым маслом.
4. Хлорирование можно прерывать, оставляя раствор на ночь.
5. Описанный способ успешно применяют для получения хлоруксусной кислоты в больших количествах.
Способы получения:
- Хлорирование уксусной кислоты в присутствии катализаторов (фосфор, сера, уксусный ангидрид) при 100-150 С. [Лит.]
- Кислотная гидратация 1,1,2-трихлорэтилена 90-93% серной кислотой при 160-180 С. [Лит.]
- Хлорирование кетена. [Лит.]
- Восстановление ди- или трихлоруксусной кислоты. [Лит.]
- Реакцией уксусной кислоты с тионилхлоридом при 115-120 С и 0,4-0,5 МПа. [Лит.]
- Хлорирование уксусной кислоты в водном растворе смесью хлоридных комплексов Pt(IV) и Pt(II). [Лит.]
- Глицин реагирует с избытком нитрозилхлорида в течение нескольких часов с образованием хлоруксусной кислоты. [Лит.1]
H2NCH2COOH + NOCl → ClCH2COOH + N2 + H2O
Используется для синтеза веществ:
1-(3,4-дигидроксифенил)-2-хлорэтанон моногидрат
аминоуксусная кислота
натрия 2,4-дихлорфеноксиацетат моногидрат
нитрометан
сульфанилуксусная кислота
хлоруксусной кислоты этиловый эфир
Показатель преломления (для D-линии натрия):
1,4351 (55°C)
Давление паров (в мм рт.ст.):
20 (104°C)
100 (132°C)
300 (160°C)
Показатели диссоциации:
pKa (1) = 2,86 (25°C, вода)
pKa (1) = 4,6 (20°C, формамид)
Диэлектрическая проницаемость:
12,3 (60°C)
Динамическая вязкость жидкостей и газов (в мПа·с):
1,29 (100°C)
Поверхностное натяжение (в мН/м):
35,17 (100°C)
Стандартная энтальпия образования ΔH (298 К, кДж/моль):
-504,6 (т)Энтальпия плавления ΔHпл (кДж/моль):
12,28Температура вспышки в воздухе (°C):
132Температура самовоспламенения на воздухе (°C):
446Теплота сгорания (кДж/моль):
715,5Стандартная энтальпия образования ΔH (298 К, кДж/моль):
-490,1 (ж)Стандартная энтальпия образования ΔH (298 К, кДж/моль):
-427,6 (г)Стандартная энергия Гиббса образования ΔG (298 К, кДж/моль):
-368,5 (г)Стандартная энтропия вещества S (298 К, Дж/(моль·K)):
325,9 (г)Стандартная мольная теплоемкость Cp (298 К, Дж/(моль·K)):
78,8 (г)Летальная доза (ЛД50, в мг/кг):
55 (крысы, внутрижелудочно, в виде 10% раствора)
Распределение и трансформация в окружающей среде и живых организмах:
В организме хлоруксусная кислота превращается в основном в S-карбоксиметил-l-цистеин и тиодиуксусную кислоту, незначительно - в гликолевую и щавелевую кислоты. При внутрибрюшинном введении хдлоуксусной кислоты, меченной углеродом-14, 80-82% радиоактивности находили в моче, 8% в выдыхаемом воздухе, 0,2-3% в кале. В моче содержалась как сама хлоруксусная кислота, так и ее метаболиты.
Симптомы острого отравления:
Человек. Порог раздражающего действия 5,7 мг/м3. У рабочих производства хлоруксусной кислоты выявлены нарушения обоняния, хронические ринофарингиты; рентгенологически - явления перибронхина, а также зуд, сухость, шелушение и ожоги кожи. У 83 из 110 обследованных ихтиозоподобные дерматиты; поражались лицо, шея, конечности, реже туловище. Выздоровление наступало через 7-30 дней после прекращения контакта с хлоруксусной кислотой. Кроме хлоруксусной кислоты в воздухе производственных помещений обнаруживались серная кислота, хлороводород, диоксид серы, трихлорэтилен.
Применение:
В синтезе красителей, лекарственных средств, гербицидов, витаминов.
Дополнительная информация::
Легко вступает в реакции нуклеофильного замещения хлора. При обработке горячим спиртовым раствором этилата натрия образует этоксиуксусную кислоту, с щелочным раствором фенола - феноксиуксусную кислоту, с цианидами щелочных металлов - циануксусную кислоту, с этилендиамином - этилендиаминтетрауксусную кислоту, с щелочами - глиоксиловую кислоту, с водным раствором гидросульфида калия - тиогликолевую кислоту. Реакция с анилином - промышленный способ получения индиго, реакцией с аммиаком получают глицин, с метиламином - саркозин, с щелочной целлюлозой - карбоксиметилцеллюлозу.
Источники информации:
- CRC Handbook of Chemistry and Physics. - 90ed. - CRC Press, 2010. - С. 5-21
- Seidell A. Solubilities of organic compounds. - 3ed., vol.2. - New York: D. Van Nostrand Company, 1941. - С. 87-92
- Вредные вещества в промышленности: Справочник для химиков, инженеров и врачей. - 7-е изд., Т.2. - Л.: Химия, 1976. - С. 7-8
- Рабинович В.А., Хавин З.Я. Краткий химический справочник. - Л.: Химия, 1977. - С. 191-192, 223
- Справочник по растворимости. - Т.1, Кн.1. - М.-Л.: ИАН СССР, 1961. - С. 378
- Химическая энциклопедия. - Т. 5. - М.: Советская энциклопедия, 1999. - С. 296-297
Если не нашли нужное вещество или свойства можно выполнить следующие действия:
Если вы нашли ошибку на странице, выделите ее и нажмите Ctrl + Enter.
© Сбор и оформление информации: Руслан Анатольевич Кипер
 Прибор для хлорирования изображен на рисунке. В трехгорлую колбу емкостью 500 мл помещают смесь 300 г (5 молей) ледяной уксусной кислоты и 15 г (0,14 моля) уксусного ангидрида и нагревают на масляной бане. По достижении температуры 105° начинают постепенно вводить хлор, поддерживая температуру масляной бани в течение всего периода хлорирования в пределах 108— 112°. Через несколько минут после начала введения хлора начинается реакция; желтая (от растворенного хлора) окраска уксусной кислоты исчезает и выделяется хлористый водород. С этого момента следует значительно увеличить скорость пропускания хлора, регулируя, однако, ее таким образом, чтобы из колбы не выходили желтые пары хлора. Хлорирование продолжают около 10 часов (примечание 4). Каждые 2 часа к хлорируемой смеси добавляют по 5 г уксусного ангидрида. Конец хлорирования определяют по значительному уменьшению количества выделяющегося хлористого водорода или путем определения температуры плавления отбираемой пробы. Хлорирование прекращают, когда проба сырой хлоруксусной кислоты будет плавиться при температуре 45—50°. Расплавленный продукт реакции переносят в перегонную колбу и после отгонки небольшого количества предгона собирают фракцию хлоруксусной кислоты, кипящую при температуре 186—188°; при застывании образуются кристаллы с резким запахом. Выход (примечание 5) — 425 г (90% от теоретического).
Прибор для хлорирования изображен на рисунке. В трехгорлую колбу емкостью 500 мл помещают смесь 300 г (5 молей) ледяной уксусной кислоты и 15 г (0,14 моля) уксусного ангидрида и нагревают на масляной бане. По достижении температуры 105° начинают постепенно вводить хлор, поддерживая температуру масляной бани в течение всего периода хлорирования в пределах 108— 112°. Через несколько минут после начала введения хлора начинается реакция; желтая (от растворенного хлора) окраска уксусной кислоты исчезает и выделяется хлористый водород. С этого момента следует значительно увеличить скорость пропускания хлора, регулируя, однако, ее таким образом, чтобы из колбы не выходили желтые пары хлора. Хлорирование продолжают около 10 часов (примечание 4). Каждые 2 часа к хлорируемой смеси добавляют по 5 г уксусного ангидрида. Конец хлорирования определяют по значительному уменьшению количества выделяющегося хлористого водорода или путем определения температуры плавления отбираемой пробы. Хлорирование прекращают, когда проба сырой хлоруксусной кислоты будет плавиться при температуре 45—50°. Расплавленный продукт реакции переносят в перегонную колбу и после отгонки небольшого количества предгона собирают фракцию хлоруксусной кислоты, кипящую при температуре 186—188°; при застывании образуются кристаллы с резким запахом. Выход (примечание 5) — 425 г (90% от теоретического).