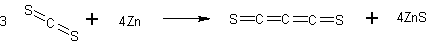
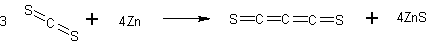
В двухлитровую круглодонную колбу, охлаждаемую до самого горла льдом, наливают 1300 мл CS2 наивысшей чистоты, который предварительно встряхивают со ртутью и с фосфорным ангидридом и затем фракционируют. Отверстие колбы неплотно закрывают пробкой с тремя отверстиями — для пропускания двуокиси углерода и для введения обоих держателей электродов, сделанных из латунной проволоки диаметром 6 мм. Цилиндрический цинковый анод (15—20 мм длиной и 6 мм диаметром) поддерживается на нижнем конце дважды согнутой под прямым углом латунной проволокой и находится непосредственно над дном. колбы. Против него находится графитовый электрод (длиной 80 мм и диаметром 12 мм), смонтированный на другой латунной проволоке. Верхний конец этой латунной проволоки передвигается механически вниз при помощи дифференциального регулятора дуги, так чтобы эта дуга не оборвалась, несмотря на испарение электродов.
Затем через колбу пропускают двуокись углерода, приводят оба электрода и соприкосновение, включают ток и затем разъединяют электроды для образования дуги. Сила тока должна достигать 4—5 а, напряжение на клеммах во время опыта должно быть 20—25 в. Раствор сероуглерода становится скоро непрозрачным из-за образования распыленного углерода.
Продукт реакции, представляющий собой буро-красную жидкость с резким запахом, отфильтровывают и остаток промывают небольшим количеством сероуглерода. Фильтрат встряхивают с 200 г ртути и небольшим количеством фосфорного ангидрида. После фильтрования выпаривают 4/5 жидкости на водяной бане и из установки при комнатной температуре насосом отсасывают весь CS2. Остающуюся в колбе красную жидкость перегоняют в высоком вакууме в приемник, охлажденный до -40 С, в которм C3S2 конденсируется в виде желто-красного твердого вещества высокой чистоты. При горении электрической дуги в течение 5 часов выход C3S2 составляет 800-850 мг (50% от теоретического).
Определение содержания C3S2 в препарате. Упаренный до нескольких миллилитров сероуглеродный раствор (100 мл) перегоняют до конца в высоком вакууме в конденсационный сосуд; конденсат состоящий только из сероуглерода и тионедоокиси углерода, обрабатывают избытком брома и оставляют на несколько часов, после чего выпаривают в токе сухого воздуха. Сухой остаток представляет собой устойчивый на воздухе бромид C3S2Br6.
Синонимы: тионедоокись углерода, трикарбодисульфид, субсульфид углерода.
Свойства: ярко-красная, сильно преломляющая жидкость с резким раздражающим слизистые оболочки запахом. Т.пл. -0,5 С. давление пара при 50 С 8 мм рт.ст., при 90 С 48 мм рт.ст. Разлагается при температуре выше 90 С. Растворы C3S2 в сероуглероде, содержащем более 1% C3S2 неустойчивы, они постепенно выделяют черные продукты полимеризации. Солнечный свет действует аналогичным образом и на более разбавленные растворы. При 160 С из чистой C3S2 получается твердый черный продукт. С анилином образует тиомалонанилид.