Главная страница
 Базы данных
Базы данных
 База данных свойств веществ (поиск)
База данных свойств веществ (поиск)
Свойства вещества:
стронций
Синонимы и иностранные названия:
strontium (англ.)
Тип вещества:
неорганическое
Внешний вид:
серебристо-бел. кубические кристаллы металлаБрутто-формула (по системе Хилла для органических веществ):
SrФормула в виде текста:
SrМолекулярная масса (в а.е.м.): 87,62
Температура плавления (в °C):
768Температура кипения (в °C):
1390Температуры полиморфных переходов (в °C):
кубические крист. (α) в гексагональные крист. (β) = 215°C
гексагональные крист. (β) в кубические крист. (γ) = 605°C
Растворимость (в г/100 г растворителя или характеристика):
аммиак жидкий: 98 (-33,4°C) [Лит.]
бромид стронция расплавленный: 16,7 (1000°C) [Лит.]
вода: реагирует [Лит.]
иодид стронция расплавленный: 14,2 (1000°C) [Лит.]
ртуть: 0,74 (0°C) [Лит.]
ртуть: 1,05 (20°C) [Лит.]
ртуть: 1,13 (23°C) [Лит.]
ртуть: 1,27 (30°C) [Лит.]
ртуть: 1,82 (64,5°C) [Лит.]
хлорид стронция расплавленный: 15,3 (1000°C) [Лит.]
Плотность:
2,63 (20°C, г/см3, состояние вещества - кристаллы)
Некоторые числовые свойства вещества:
Год открытия: 1808 (Дэви Г.)
Нормативные документы, связанные с веществом:
- ПНД Ф № 14.1:2:4.135-98 издание 2005 г. "Методика выполнения измерений массовой концентрации металлов методом атомно-эмиссионной спектроскопии с индуктивно-связанной плазмой в питьевой, природной и сточной водах и атмосферных осадках." (Описание документа: Анализ вод методом ICP.)
Реакции вещества:
- Легко воспламеняется на воздухе с образованием оксида и нитрида стронция. [Лит.]
- При нагревании до красного каления в струе азота образует нитрид стронция. [Лит.]
- Реагирует с водой. [Лит.]
- Реагирует с этанолом с выделением водорода. [Лит.]
- Реагирует с разбавленными кислотами с выделением водорода. [Лит.]
- Растворяется в жидком аммиаке с образованием темно-синих растворов, при упаривании которых остается гексаамминстронций. [Лит.]
- Реагирует с водородом выше 200 С с образованием гидрида стронция. [Лит.]
Реакции, в которых вещество не участвует:
- Почти не подвергается действию концентрированных растворов щелочей. [Лит.]
- Не реагирует с жидким тетраоксидом диазота или его смесями с этилацетатом или ацетонитрилом. [Лит.]
Периоды полураспада:
10038Sr = 202 мс (β- (100%), β-n (0,78%))
10138Sr = 113,8 мс (β- (100%), β-n (2,37%))
10238Sr = 69 мс (β- (100%), β-n (5,5%))
10338Sr = 53 мс (β- (100%), β-n )
10438Sr = 50,6 мс (β- (100%), β-n )
10538Sr = 39 мс (β- (100%), β-n )
10638Sr = 21 мс (β- (100%), β-n)
7438Sr = 27 мс (β+ (100%))
7538Sr = 88 мс (β+ (100%), β+p (5,2%))
7638Sr = 7,89 с (β+ (100%), β+p (0,000034%))
7738Sr = 9,0 с (β+ (100%), β+p (0,08%))
7838Sr = 156,1 с (β+ (100%))
7938Sr = 2,25 мин (β+ (100%))
8038Sr = 106,3 мин (β+ (100%))
8138Sr = 22,3 мин (β+ (100%))
81m38Sr = 390 нс (изотопный переход (100%))
81n38Sr = 6,4 мкс ()
8238Sr = 25,36 дня (захват электрона (100%))
8338Sr = 32,41 ч (β+ (100%))
8438Sr = стабилен ( (содержание в природной смеси изотопов 0,56%))
8538Sr = 64,853 дня (захват электрона (100%))
85m38Sr = 67,63 мин (изотопный переход (86,6%), β+ (13,4%))
8638Sr = стабилен ( (содержание в природной смеси изотопов 9,86%))
86m38Sr = 455 нс (изотопный переход (100%))
8738Sr = стабилен ( (содержание в природной смеси изотопов 7%))
87m38Sr = 2,815 ч (изотопный переход (около 100%), захват электрона (0,30%))
8838Sr = стабилен ( (содержание в природной смеси изотопов 82,58%))
8938Sr = 50,53 дня (β- (100%))
9038Sr = 28,79 лет (β- (100%))
9138Sr = 9,65 ч (β- (100%))
9238Sr = 2,611 ч (β- (100%))
9338Sr = 7,43 мин (β- (100%))
9438Sr = 75,3 с (β- (100%))
9538Sr = 23,90 с (β- (100%))
9638Sr = 1,07 с (β- (100%))
9738Sr = 429 мс (β- (100%))
9838Sr = 653 мс (β- (100%), β-n (0,25%))
9938Sr = 269 мс (β- (100%), β-n (0,10%))
Давление паров (в мм рт.ст.):
0,01 (533°C)
0,1 (621°C)
1 (733°C)
10 (877°C)
100 (1097°C)
Удельная теплоемкость при постоянном давлении (в Дж/г·K):
0,31 (25°C)
Стандартная энтальпия образования ΔH (298 К, кДж/моль):
0 (т)Стандартная энергия Гиббса образования ΔG (298 К, кДж/моль):
0 (т)Стандартная энтропия вещества S (298 К, Дж/(моль·K)):
53,1 (т)Стандартная мольная теплоемкость Cp (298 К, Дж/(моль·K)):
27,2 (т)Энтальпия плавления ΔHпл (кДж/моль):
9,2Энтальпия кипения ΔHкип (кДж/моль):
141,4Стандартная энтальпия образования ΔH (298 К, кДж/моль):
161 (г)Стандартная энтропия вещества S (298 К, Дж/(моль·K)):
164,5 (г)Стандартная мольная теплоемкость Cp (298 К, Дж/(моль·K)):
20,8 (г)Анализ вещества:
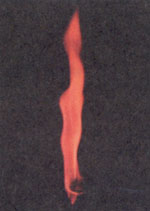 Соли стронция окрашивают пламя в карминово-красный цвет (на фото).
Соли стронция окрашивают пламя в карминово-красный цвет (на фото).
Дополнительная информация::
Электронная конфигурация атома 1s22s22p63s23p63d104s24p65s2.
Медленно реагирует с концентрированной серной кислотой. На воздухе быстро покрывается пленкой оксидов и нитридов. При нагревании легко реагирует с водородом образуя гидрид стронция. Быстро реагирует с водой с выделением водорода и образованием гидроксида стронция. Легко растворяется в минеральных кислотах с выделением водорода, при реакции с разбавленной азотной кислотой в значительных количествах образуется нитрат аммония и водород. При нагревании с галогенами дает галогениды.
Содержание элемента в земной коре 0,04%.
Дополнительная информация:
При повышении давления электрическое сопротивление стронция повышается достигая максимума (в 5 раз больше, чем при обычном давлении) при 37 000 атм, а затем начинает снижаться.
Источники информации:
- Гурвич Я.А. Справочник молодого аппаратчика-химика. - М.: Химия, 1991. - С. 51
- Карапетьянц М.Х., Дракин С.И. Общая и неорганическая химия. - М.: Химия, 1981. - С. 309-316
- Полуэктов Н.С., Мищенко В.Т., Кононенко Л.И., Бельтюкова С.В. Аналитическая химия стронция. - М.: Наука, 1978. - С. 13-14
- Рабинович В.А., Хавин З.Я. Краткий химический справочник. - Л.: Химия, 1977. - С. 99
- Энциклопедия для детей. - Т.17: Химия. - М.: Аванта+, 2004. - С. 195
Если не нашли нужное вещество или свойства можно выполнить следующие действия:
Если вы нашли ошибку на странице, выделите ее и нажмите Ctrl + Enter.
© Сбор и оформление информации: Руслан Анатольевич Кипер
 Соли стронция окрашивают пламя в карминово-красный цвет (на фото).
Соли стронция окрашивают пламя в карминово-красный цвет (на фото).
 Соли стронция окрашивают пламя в карминово-красный цвет (на фото).
Соли стронция окрашивают пламя в карминово-красный цвет (на фото).