Вещества имеющие строение R-NC. Изомерны нитрилам.
Методы получения изоцианидов.
Несмотря на амбидентный характер, цианид-ион алкилируется преимущественно по углероду при действии алкилгалогенидов и сульфатов; при этом в основном образуются нитрилы, изоцианиды являются минорными продуктами. В то же время "связывание" цианид-иона в комплекс с тяжелым металлом, таким как серебро или медь, приводит к тому, что алкилирование идет преимущественно по азоту. Таким образом, при реакции цианида серебра(I) или цианида меди(I) с алкилиодидом образуется изоцианидный комплекс, который реакцией с цианидом калия можно перевести в свободный изоцианид. Выходы изоцианидов в этом классическом методе синтеза, однако, невелики, не выше 55%. Эффективность этого метода можно заметно повысить, если в качестве изоцианируюшего агента использовать комплекс цианида серебра с трифенилметилфосфонийгалогенидом, поскольку его можно применять в гомогенной среде в апротонных растворителях. Было показано, что алкилгалогениды, в особенности алкилиодиды, в некоторых случаях можно перевести в изоцианиды практически с количественным выходом, проводя реакцию с дицианоаргентатом тетраметиламмония.
Другой классический метод синтеза изоцианидов (карбиламинная реакция Гофмана) состоит во взаимодействии первичного амина с хлороформом в присутствии сильного основания, например спиртового раствора едкого кали или раствора трет-бутоксида калия в трет-бутиловом спирте. Недостатком этого метода, однако, является то, что его нельзя использовать, если субстрат или продукт чувствительны к основаниям.
Изоцианиды могут быть получены с хорошими выходами дегидратацией N-монозамещенных формамидов действием самых разнообразных реагентов (например, Р2O5, РСl3, SOCl2, СОCl2, ArSO2Cl, РОСl3) в присутствии оснований (например, ди- и триалкиламинов, пиридина, трет-бутоксида калия). Этот метод наиболее широко используют для синтеза изоцианидов.
Реакции изонитрилов
При 200-250 С подвергаются термической изомеризации в нитрилы.
Реакции с электрофильными реагентами
При комнатной температуре изоцианиды бурно реагируют с галогенами; при низкой температуре эти реакции становятся контролируемыми, при этом продуктами являются R-N=CHal2. Столь же энергично реагируют изоцианиды и с безводными галогеноводородами (HCl, HBr, HI); проведение реакции при -15 С позволяет получить формимидоилгалогениды (в виде галогеноводородных солей). Изоцианиды, по-видимому, устойчивы к действию алкилирующих агентов, но с ацилхлоридами, напротив, реагируют охотно и дают альфа-кетоамидоилхлориды. При взаимодействии карбоновых кислот с изоцианидами получают ангидриды кислот и формамиды.
Реакции с нуклеофильными реагентами
Изоцианогруппа обладает преимущественно нуклеофильным характером и поэтому устойчива к нуклеофильным атакам. Вследствие этого изоцианиды довольно стабильны в условиях щелочного гидролиза и не реагируют с такими нуклеофилами, как спирты и амины, даже в жестких условиях. Однако в условиях кислотного катализа изоцианиды вступают во взаимодействие с нуклеофильными реагентами. Именно этим можно объяснить легкий кислотный гидролиз изоцианидов, приводящий к формамидам, из которых в свою очередь можно получить первичные амины. Аналогично реагируют изоцианиды и с сероводородом, давая тиоформамиды.
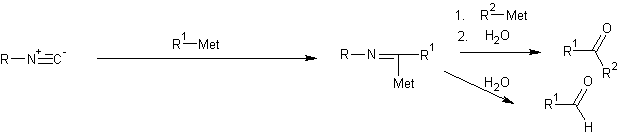
Изоцианиды, не содержащие альфа-водородного атома, гладко присоединяют литийорганические реагенты и реактивы Гриньяра и дают металлоальдимины. Эти соединения можно использовать как интермедиаты в различных реакциях; например, их можно превратить путем гидролиза соответствующих альдиминов в альдегиды с высоким выходом или же использовать как эквивалент ацил-карбаниона. Так при их алкилировании и последующем гидролизе получают кетоны, также с высоким выходом.

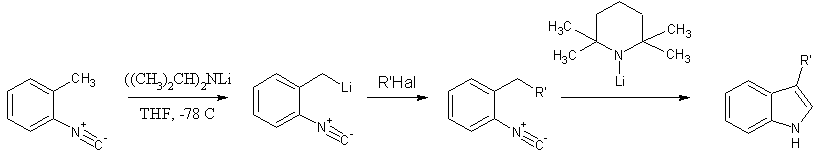
Было осуществлено внутримолекулярное присоединение карбаниона к изоцианидной группе, позволившее перейти от орто-метилированных ариламинов к индолам с высоким выходом (86-100%); реакция протекает через стадии образования о-метиларилизоцианидов и их металлирования, сопровождающегося циклизацией. Было показано, что первоначально образующийся литийорганический реагент можно проалкилировать, а затем снова прометаллировать и получить в результате 3-замещенные индолы.