Содержание
Введение
Номенклатурные правила, опубликованные Международным союзом чистой и прикладной химии IUPAC, приняты в большинстве стран и, таким образом, являются международно признанными как химиками-органиками, так и неорганиками.
Секция А, В и С правил органической номенклатуры IUPAC 1969 г., которые заменяют опубликованные ранее [1958 г.], охватывают большую часть органической химии, но с трудом применимы к некоторым специальным областям. Номенклатура органических производных фосфора, мышьяка, сурьмы, висмута, органометаллических соединений, координационных комплексов опубликована в 1978 г. лишь в виде временных правил, изданных совместно комиссиями по номенклатуре органической и неорганической химии. Ряд областей, представляющих большой интерес как для биохимии, так и для органической химии, рассмотрен совместно Комиссиями IUPAC и UIB (UIB - Международный союз биохимии) и выработаны некоторые ценные предписания.
Часто пытающийся изучать номенклатуру, читая эти правила, находит их сложными, произвольными и неопределенными в силу возможности различного толкования. Эта затруднительная ситуация возникла вследствие желания IUPAC (равно как и всех химиков) сохранить как можно больше все еще применяемых привычных названий. Многие такие привычные названия являются очень старыми: например, кислоты и их производные были названы по дуалистическому принципу, памятному химикам старых времен, а амины часто называют по принципам теории типов, разработанной в середине девятнадцатого столетия. Кроме того, химики неохотно отказываются от множества сокращенных обозначений (названий). Добавьте к этому многие тысячи чисто тривиальных наименований (частично старых, частично новых), тогда полностью логичная, легко понимаемая номенклатура, совместимая с компьютерной техникой, представится особенно желанной целью. Однако даже если бы это было осуществимо, такое совершенно новое начинание встретит, в лучшем случае, лишь постепенное признание химиков, привыкших к общепринятой терминологии. Таким образом, хотя будущее представляется более радужным, современная номенклатура IUPAC заслуживает изучения, невзирая на ее недостатки, по крайней мере потому, что ее основные положения в значительной мере используются в указателях реферативных журналов РЖ Химия, Chemical Abstracts (CA). Chemical Abstracts опубликовал материалы, посвященные названиям органических соединений, специально предназначенные для читателей, пользующихся указателем химических соединений. Издание 1972 г. заменяет и существенно видоизменяет более раннее издание, с тем чтобы в дальнейшем, по крайней мере до 1982 г., оно существенно не изменялось. Основное английское руководство по органической номенклатуре, опубликованное под редакцией Флетчера, Дермера и Фокса, придает особое значение принципам и систематизации; оно содержит меньше альтернатив, нежели разрешено правилами IUPAC, но более детализировано, нежели данная книга.
Технические термины
Систематические названия - названия, полностью составленные из слов, специально созданных или выбранных для описания структурных особенностей соединения, например: гексан, тиазол.
Тривиальные названия - названия, ни одна часть которых не используется в систематическом смысле, например: ксантофилл, фуран.
Полусистематические - полутривиальные названия - названия, в которых лишь некоторые части применяются в систематическом смысле, например: метан, бутан, кальциферол. В органической химии большинство названий относится к этому типу; многие химики о них часто говорят как просто о "тривиальных", но это неточно и неправильно.
Родоначальные названия. Мы можем представить бензол как химический родоначальник нитробензола, так как последний получается из первого. Соответственно бензол является родоначальным названием для нитробензола, так как название второго производится из названия первого по определенным правилам. Однако родоначальные названия не всегда указывают на химическое родство: этан вряд ли является химическим родоначальником этанола, хотя этан и образует родоначальную структуру для названия поседнего. Часто возникают родословные цепи, например: гексан - 3-метилгексан - 3-(хлорметил)гексан, или сложные родословные - бензантрацен, происходящий от бензола и антрацена. Существенно еще раз подчеркнуть, что родоначальное название может быть как систематическим (например, гексан), так и тривиальным (например, фуран) или полутривиальным (например, метан).
Группы, или радикалы. Во многих соединениях часто встречаются нейтральные группы атомов, связанных тем или иным образом между собой, например: СН3, СН2, ОН, NO2, СО, СООН и др. В номенклатурном языке такие группы обычно называют радикалами. В номенклатурных работах при обозначении свободных радикалов обычно неизменно подчеркивают, что это "свободные" радикалы.
Функции, функциональные группы. В английскую химическую номенклатуру термины "функция" и "функциональная группа" вошли при переводе французского текста правил IUPAC 1930 г. (fonction, fonctionnel) без какого-либо пояснения. Функциональной группой является группа атомов, определяющая "функцию", или характер активности соединения. Так, свойства спиртов определяются функциональной группой ОН. В данном случае функциональная группа, гидроксил, является химической группой того же названия. Кетоны обязаны своими свойствами атому кислорода, связанному с атомом углерода двойной связью. В данном случае кетонной функцией является О=(С) (без углерода), и это не то же самое, что карбонильная группа О=С<. Аналогично, карбоксильная функция изображается формулой HOO(C), а карбоксильная группа- формулой HOOC. В химической литературе понятая "функция", "группа" и "радикал" часто используются как синонимы, однако на самом деле они не взаимозаменимы. Обычно термины группа, или радикал более точно отвечают смыслу. Отметим, что в справочнике Бейльштейна подразделение заместителей на "функциональные" и "нефункциональные" не соответствует такому определению. Например, нитрогруппа, несомненно определяющая характер активности нитробензола, в справочнике Бейльштейна рассматривается как нефункциональная.
Главная (старшая) группа. Этим термином обычно обозначают функциональную группу, название которой отмечается в суффиксе, или же, если в соединении содержатся функциональные группы различного характера, то ту из них, которую следует назвать в суффиксе. Для названия "главная" имеются два основных соображения. Первое из них заключается в том, что такая группа точно указывает на принадлежность соединения к определенному химическому классу и на те свойства, которые у него можно ожидать. Второе соображение состоит в том, что выбранный суффикс предопределяет выбор родоначального соединения и нумерации. Выбор суффиксов подчиняется определенным правилам, описанным ниже. Здесь же следует отметить, что эти правила не вполне логичны - так, некоторые функциональные группы никогда не называются в суффиксе; ненасыщенность выражается особым образом.
Использование термина "главная (старшая) группа" для группы, обозначаемой суффиксом, дает возможность должным образом использовать термины "функция" и "функциональная группа" и избегать часто встречающихся ошибок.
Локант. Это полезное слово обозначает цифру и/или букву, указывающие на положение того или иного атома или группы в молекуле.
Способы записи названий
Способы записи названий химических соединений причиняют много хлопот ученым, так как не всегда выявляются в разговорной речи. Кроме того, они варьируют в разных странах, а подчас и в разных журналах одной и той же страны. Отчасти это делается из лингвистических соображений, отчасти отражает личные вкусы авторов. Некоторые подобные различия химики легко преодолевают, другие различия требуют серьезного изучения. Например, очень существенно знать различие между написанием 1,2,5,6- и 1,2:5,6, а также помнить, что в большинстве предметных указателей префиксы, набранные курсивом, не учитываются при расстановке названий в алфавитном порядке, и таким образом изобутиламин следует искать под буквой И, а втор-бутиламин - под буквой Б.
Особенно огорчительными являются некоторые разночтения между номенклатурами СА и Британского химического общества. В первых трех изданиях этой книги применялись британские правила, а в четвертом и настоящем - пятом - американские. Это связано с тем, что последние приняты в компьютерной (ЭВМ) технике службы химической информации Соединенного королевства (United Kingdom Chemical Information Service, (CIS) и другими организациями, а также потому, что американские публикации наиболее многочисленны.
Цифры являются локантами, когда они указывают положение заместителя или связи в структуре молекулы. Две или более цифры, отделенные запятыми, указывают на положение двух или более одинаковых заместителей, например: 1,2,4,5-тетрабромциклогексан. Если имеется несколько заместителей, каждый из которых занимает два (или подчас более) положения в молекуле, то пары (тройки и т. д.) цифр разделяются двоеточиями, как в названии 1,2:5,6-ди-О-изопропилиденглюцит. После запятых или двоеточий пробела не делается. Одиночные цифры или их наборы соединяются с последующими или предшествующими частями названия с помощью дефисов. В немногочисленных специальных случаях наряду с цифрами локантами служат и буквы; тогда они следуют непосредственно за цифрами, между ними и дефисом или запятой, например: За- или (7b).
В названиях бицикло-, трициклосоединений и ряда спиросоединений цифры разделяются точками, опять-таки без интервалов. Однако эти цифры не являются локантами.
Цифры-локанты располагаются в возрастающем порядке. Не меченная штрихом цифра считается младше такой же меченной штрихом, которая, в свою очередь, считается младше меченной двумя штрихами. Однако меньшая меченая цифра считается младшей по сравнению с большей немеченой. Примером может служить следующая последовательность: 2,2,2',3,3',3'',4. В особых случаях, например в названиях бицикло- или спиросоединений, делается исключение из этого порядка расположения цифр.
Локанты помещаются в названии вещества как можно раньше, если это не может вызвать недоразумения. Простыми примерами могут служить названия 2-хлорогексан, 3-метил-2-хлорогексан или 2,3-дихлорогексан.
Американская практика распространяет эти правила на локанты суффиксов, как это видно на примерах названий: 2-гексанол, 2,3-гександиол, 2-фенантренкарбоновая кислота и 2-гексен. Однако это применимо лишь для одного типа подобных окончаний. Если же их больше, то локант, указывающий на положение первого, помещается перед названием вещества, а последующие предшествуют своим суффиксам, например: 2-гексен-4-ин, 3-гексен-5-ин-2-ол.
Английская традиция помещает локанты непосредственно перед суффиксами, например: гекс-2-ен или гекс-3-ен-5-ин-2-ол. Однако большинству химиков в других странах это не нравится, так как неизбежно сильно разбивает слово при устном произношении. Но данная система записи утверждена правилами ИЮПАК 2013 года.
В русской номенклатуре, как уже указывалось, локанты располагают перед префиксами и после суффиксов, например: гексен-2-ин-4, гексен-3-ин-6-ол-2.
Имеются также случаи, когда локанты суффиксов не могут быть перемещены влево, например, когда другой локант на основании специального правила должен занять это место. Таковы, например, названия 5а-холестан-3-он, 2Н-пиран-3-ол или бицикло[3.3.0]окт-2-ен.
Так же широко распространены однобуквенные локанты, часто это набираемые курсивом символы элементов. Для идентичных групп такие локанты располагаются в алфавитном порядке, вне зависимости от того, является ли буква прописной или строчной. Буквы латинского алфавита предшествуют буквам греческого алфавита. Как и цифры, буквы могут быть помечены штрихами, и тогда они располагаются по тем же правилам старшинства. Иногда встречаются и такие смешанные случаи, как N,α,2-триметил.
Обычные обозначения положений заместителей в бензоле - о- (орто), м- (мета) и п- (пара) были отвергнуты в СА и правилами ИЮПАК 2013 года, предпочитающим цифровые обозначения, например: 1,4-дихлоробензол.
Обычно применяемые в органической химии числовые (множительные) префиксы это: моно - 1, ди - 2, три - 3, тетра - 4, пента - 5, гекса - 6, гепта - 7, окта - 8, нона - 9, дека - 10, ундека - 11, додека - 12, тридека - 13… эйкоса - 20, генэйкоса - 21, докоса - 22, трикоса - 23, тетракоза - 24… триаконта - 30, гентриаконта - 31, дотриаконта - 32… тетраконта - 40, гекта - 100, генгекта - 101, догекта - 102, дотриаконтагекта - 132, дикта - 200, тритетраконтадикта - 243, трикта - 300, тетракта - 400, килиа - 1000, дилиа - 2000, трилиа - 3000, тетрилиа - 4000, ноналиа - 9000. Для всех сложных выражений СА применяет умножающие префиксы бис-, трис-, тетракис-, и т. д. Чаще всего их используют в названиях соединений со сложными радикалами, например: бис(диметиламино), трис(2-хлороэтил) и др. Это распространено и на те случаи, когда применение скобок вносит ясность в название, как в случае бис(диазо), трис(гидрофталат) и трис(метилен). Последний случай позволяет избежать путаницы с триметиленом, имеющим строение -СН2СН2СН2-.
Практика английской номенклатуры более свободна. Так, умножающие префиксы бис- (и аналогичные) применяются, когда следующий слог также умножающий, как, например, в случае бис-2,2,2-трихлороэтила. Применение скобок не считается обязательным. В то же время допускается в равной мере написание со скобками - ди (2-хлороэтил). Можно указать и еще на одно отличие. Англичане ставят дефис между префиксом и скобкой, как, например, в случае трис-(2-хлороэтил), американцы же считают дефис излишним, если за префиксом стоит скобка; согласно их традиции следует писать трис(2-хлороэтил). В русской литературе используют американский вариант. Американский вариант также утвержден правилами ТЮПАК 2013 года.
Как уже отмечалось, во избежание возможных ошибок СА использует круглые скобки ( ) для отделения наименования радикала от основного соединения, например: 2-(бромометил), (фенилазо), 2-(2-тиенил) и др. Во многих сложных случаях добавляются квадратные скобки [ ], например: 2-[1-(диэтиламино)этил]бензойная кислота или 9-[2-(дихлорометокси)этил]фенантрен. Английские правила применения скобок менее строги, и в зависимости от химического смысла применяются либо круглые скобки, либо также и фигурные. При возможности разночтений американская практика также основывается на соображениях химического смысла. Например, СН3РНСl называется метилхлорофосфином, в то время как РН2СН2Сl - (хлорометил)фосфином; другой пример - глюкозо-6-(дигидрофосфат). Сокращенные названия, такие, как метокси, в скобки не заключаются, в то время как несокращенные, например гептилокси и др., заключаются. Иногда выделение лигандов также осуществляется с помощью круглых скобок, например: бромо(метил)ртуть CH3HgBr.
Так как слоги, напечатанные курсивом, не учитываются в алфавитном порядке расположения наименований соединений в указателях, использование курсива особо отмечается в последующем тексте. Почти всегда назначение курсива состоит просто в обеспечении того, что соответствующее название будет помещено в наиболее подходящем месте, где группируются изомеры и родственные соединения. Это главное, отсутствие же различий в устной речи не имеет значения.
В редких случаях, когда префикс, обозначенный курсивом стоит в начале абзаца или после точки, он пишется строчными буквами, а следующая за дефисом буква пишется прописной, например: м-Ксилол или транс-Бутен-2. Даже в том случае, когда курсивный префикс напечатан прописной буквой, он все равно не служит основной буквой, означающей начало названия соединения, например: N-Метилацетамид.
Между частями названия, кончающимися и начинающимися согласными буквами (в частности, буквой "h" в английском алфавите), для благозвучия обычно вставляется буква "о". Например: ацетогидроксамовая кислота, но не ацетгидроксамовая кислота.
В простых группах в формуле первым пишется центральный атом, например: СН3, СН2, NO2, N(CH3)2, NH(CH3) и т. д.; СН3СН2 может быть сокращен до С2Н5, аналогично могут быть сокращены гомологичные нормальные алкилы. Если простая группа стоит слева в формуле, то порядок атомов в ней может быть изменен так, чтобы была ясна связь между атомами, как в случае O2N-СН2СН2-ОН или ON-О-СН2СН2-ОН. В английских журналах следующие друг за другом группы в линейных формулах часто разделяют точками, помещенными в середине строки, например: СН3·СН2·СН2·ОН. Однако часто считают, что такими точками следует обозначать только свободные радикалы или продукты присоединения. В американской номенклатурной практике для изображения линейных сочинений такие "английские" точки (посредине строки) никогда не применяются; для обозначения наличия связи между атомами используются дефис или линии посреди строки, как в формуле O2N-СН2-СН2-ОН.
Круглые скобки применяются в линейных формулах в трех случаях. Во-первых, в них заключают одинаковые группы, идентично связанные с соседним атомом, как в случае (СН3)2СНС(СН3)3. Во-вторых, в скобки заключают цепи последовательно соединенных одинаковых групп, как в случае CH3(CH2)4CHO. И наконец, в третьих, скобки могут означать, что заключенная в них группа не включена в цепь, а является боковой группой или разветвлением в данной цепи, например: СН3СН2СН(СН3)СН2ОН или Сl2Р(О)СН3. СА заключает в скобки все боковые группы в линейных формулах, например: СН3СН(ОН)СН2ОН или C6H5CH(NH2)CH2CH3, однако даже и без скобок вряд ли кто-либо поймет эти формулы ошибочно.
Некоторые символы групп (условные обозначения групп атомов), очень часто встречающиеся как в английских, так и в американских публикациях, часто имеют специальные сокращения, такие как Me, Et, н-Pr, Ph и т.д. Отметим, что в ранг правила IUPAC эта символика, однако, не возведена.
Неразветвленные алкильные группы называют без символа "н", например, гептил, но формулы должны писаться с этим символом, а именно: н-С7Н15, а не просто C7H15, ибо последняя представляет общую формулу многих изомеров.
Некоторые символы используются очень широко. Главным из них является R, обычно обозначающий углеводородный радикал, преимущественно одновалентный. Если имеется много различных радикалов, то их следует снабжать штрихами R, R', R"... или цифрами R1, R2, R3, но не R1, R2, R3, что означает наличие одного, двух или трех одинаковых радикалов. Для обозначения арильной группы часто применяется символ Аr, хотя он и аналогичен атомному символу аргона; для групп, отличных от R, применяют символ X.
В ряде специальных номенклатур, в частности используемых в биохимии и химии координационных соединений, для краткости применяют специальные символы, а также акронимы. Так, для обозначения широко применяемых органических растворителей используют сокращения: тетрагидрофуран - ТГФ, диметилсульфоксид - ДМСО и др. Было бы очень целесообразно, чтобы для лучшего взаимопонимания публиковались списки сокращений и ряда других символов, применяемых авторами в своих текстах.
Старая проблема изображения формулы бензола в правилах IUPAC, СА и большей части английской литературы решается в пользу формул с указанием двойных связей. Однако в американских учебниках и журналах нередко используют формулы с указанием объединенных электронных пар в виде круга.
В американской практике разделение химических терминов дефисами применяется значительно реже, нежели в английской. В первой родовые наименования бифункциональных соединений, если они являются простыми словами, пишутся раздельно без дефиса. Так, по американской практике пишут chloro alcohol, amino acid, но тем не менее bromoalkanols, aminoalkanoic acids (для последнего случая не следует писать aminocarboxylic acids). В английской практике в такие наименования обычно включают дефисы, например: chloro-alcohol, oxo-steroid, равно как и в случаях, когда название состоит из двух частей, из которых первая оканчивается произносимой гласной буквой, например: amino-derivate, thia-compounds. В английской практике дефис применяют в химическом названии также для разделения двух одинаковых букв, например: tetra-acetate, methyl-lithium, а также для облегчения чтения таких слов, как co-ordination, no-ionized. В американской практике ни в одном этих случаев дефис не ставится. В русской номенклатуре во всех приведенных примерах названия записывают слитно, за исключением: аминоалкановая кислота, метильный заместитель.
Компоненты аддуктов согласно правилам ИЮПАК 2013 года отделяются друг от друга тире (длинным дефисом).
Специфика других языков
В общем, химические термины гораздо легче переводить с иностранных языков, нежели прочий текст, так как эти термины на разных языках всегда имеют некоторое сходство с той или другой не слишком устаревшей системой наименований, применяемой в Англии или США. Имеются хорошо известные соединения, названия которых представляют исключения из приведенного выше, несколько смягченного утверждения. Примерами здесь могут служить обычные металлы и газы, а также некоторые органические соединения, такие, как уксусная и муравьиная кислоты. Большинство затруднений связано со сходством названий, за которыми скрывается различный смысл. Приведенные ниже примеры могут оказаться полезными для разрешения подобных затруднений.
Основным источником ошибок при переводе с немецкого языка является то, что за небольшими исключениями буква "-е", заканчивающая слово, является признаком множественного числа данного слова (в английском языке эту функцию выполняет буква "-s"). Можно привести следующие примеры: английские наименования: aniline, nitroanilines, phenol, phenols, thiazole, thiazoles; немецкие наименования: Anilin, Nitroaniline, Phenol, Phenole, Thiazol, Thiazole. Таким образом, в немецком языке невозможно отличить основные окончания "-ine" от неспецифических "-in" (tannin, protein, anthocyanidin, vitamin и др.) и спиртовые или фенольные "-ol" от "-ole", обозначающие также гетероароматичность в пятичленных кольцах. В итоге, при недостаточно внимательном чтении значение немецкого терминального "-е" может быть не понято.
Склонность немецкого языка к построению сложных слов составленных из многих существительных, проявляется также и в усложнении химической номенклатуры. Например, для понимания такого термина, как "Acetessigsaureethylesterdinitrophenylhydrazon", следует серьезно задуматься и расчленить его на составные части. Еще более трудно разобраться в немецком наименовании, где оказывается больше дефисов, чем в английском, например: "Chloro-bromo-phenylnaphtalin", или, наоборот, где их меньше, как в случае "Chloro-und Bromonaphtaline". По-видимому, здесь следует специально отметить, что на немецком языке (как и на русском) простые ароматические углеводороды называют "бензол", "толуол" и "ксилол", что до недавнего времени удерживалось и в англо-американской технологии.
В целом, влияние номенклатуры Бейльштейна-Штельцнера на немецкую химическую литературу еще весьма значительно, хотя номенклатура IUPAC в силу большей простоты (скорее в силу меньшей сложности!) постепенно внедряется все шире, что связано также с большим числом публикаций "Chemical Abstracts Service" по вопросам номенклатуры.
Применительно к французскому языку проблема концевой буквы "-е" имеет иное значение, а именно - фонетическое. Окончания "-in" и "-аnе" (в английском языке) для безазотных циклов переводятся на французский язык как "-inne" и "-аnnе". Однако наибольшей трудностью во французской номенклатуре для человека, читающего и думающего по-английски, является то, что цифровые и буквенные локанты помещаются после наименования структурных единиц и отделяются пробелами от последующих структурных единиц. Таким образом, название разделяется на много слов. Например, соединение (ClCH2)2CHCH2CH(CHClCH3)CH2CH2CH3 по-французски называют Chloro-1 (chloro-1 ethyl) -4 chloromethyl-2 heptan. Это относится также к образованию названий солей и сложных эфиров, например: "acetate de sodium" или "malonate de diethyle".
Лозак опубликовал отлично изложенную французскую номенклатуру органических соединений, воспроизведя последние правила IUPAC (с незначительными модификациями). Там приведены также краткое историческое введение и очень ценные комментарии к отдельным разделам и правилам.
Вариант правил IUPAC на немецком языке был опубликован в виде отдельных разделов книги со сменяемыми частями (границами). Холланд написал на немецком языке учебник по номенклатуре органических соединений, где изложил как принципы номенклатуры IUPAC, так и другие, старые и новые варианты номенклатур; в нем приведено 916 литературных ссылок.
Русская химическая литература в настоящее время представляет меньше трудностей для иностранцев, нежели раньше, так как многие русские книги и журналы публикуются в английском переводе. Однако читатель должен иметь в виду, что русской номенклатуре, которая часто ориентируется больше на Бейльштейна, чем на правила IUPAC, представляется много свободы привычкам авторов. Эти особенности представляют наибольшие затруднения при ознакомлении с многочисленными работами русских ученых в области, например, фосфорорганических соединений.
Что касается других стран, в частности Скандинавских, Японии, Голландии и Бельгии, то в них неуклонно возрастает тенденция к публикации работ на английском языке в традициях СА и IUPAC.
Типы номенклатур
Существует принципиальное различие между тривиальными и систематическими названиями соединений: тривиальные названия относятся к веществам, систематические - к структурам, т. е. к структурным формулам. Тривиальные названия не зависят от структуры; они могут быть созданы (и часто так оно и бывает на самом деле) до установления структуры, а когда структура становится известной, такое название охватывает все динамические вариации, обусловленные таутомерией и т. д. Поскольку систематическое название выведено из формулы вещества, оно не может быть приложимо к его таутомеру (хотя обычно название применяют ко всей совокупности мыслимых граничных структур). Из примерно четырех миллионов ныне (1983 г.) известных органических соединений многие тысячи имеют тривиальные или полутривиальные названия. Каждое из них не является вполне логичным, и требуется немалое напряжение памяти, чтобы вспомнить соответствующую структуру.
Конечно, каждый может запомнить лишь малую часть этих названий, но они неизбежно бытуют, отчасти в силу привычки, отчасти в силу того, что систематические названия (в частности, для макромолекул, таких как пептиды или нуклеиновые кислоты) крайне громоздки и неудобны для применения. Было бы очень полезно избегать появления новых тривиальных названий, если в этом нет крайней необходимости, а в простых случаях заменять старые тривиальные названия на систематические.
В полутривиальном названии, согласно определению, имеется частичное указание на структуру вещества (например, название этанол свидетельствует о спиртовой природе вещества). Важно, чтобы такие названия составлялись правильно, например, чтобы фенолы с кислотными свойствами не назывались кислотами (такие названия, как карболовая и крезоловая кислогы, вышли из употребления, в то время как название "пикриновая кислота" может служить примером еще встречающегося архаизма). Модификация тривиальных названий для описания производных должна делаться в соответствии с правилами систематической номенклатуры.
В силу способности атомов углерода к образованию ковалентно связанных цепей и циклов, в том числе и с включением гетероатомов (т. е. атомов иных, нежели углерод), строение органических соединений существенно отличается от строения большинства неорганических соединений. Поэтому в основе органической и неорганической номенклатур лежат совершенно различные принципы. Номенклатура органических соединений развивалась медленно и постепенно; в результате в настоящее время в ней можно различить не менее девяти принципов и несколько специальных положений. Последние будут рассмотрены в дальнейшем в соответствующих местах. Основные же принципы характеризуются тем, что в большинстве случаев они в равной степени применимы как к тривиальным, полутривиальным, так и к систематическим названиям.
(1) Основным принципом является замещение, т. е. замена атома водорода другим атомом или группой. Например, замена водорода на хлор (хлорирование), на нитрогруппу (нитрование), на метильную группу (метилирование) - даже в тех случаях, когда такие замещения не отражают реальных путей синтеза.
Однако необходимы некоторые ограничения. Например, хлорирование означает замену Н на Сl; этот термин не должен применяться к реакции присоединения, или для замены. Очевидным исключением служит реакция гидрирования.
Замещение описывается введением суффикса (этан, этанол) или префикса (бензол, хлоробензол), потеря атома водорода не учитывается.
(2) По заместительной номенклатуре структуре 2-С10Н7СН2СН2ОН дают название нафтил-2-этанол, указывающее на замещение водорода в этаноле нафтильным радикалом. Однако это название неудачно для использования в указателе; родоначальной частью в нем является этанол, и после инверсии в указателе будет значиться: Этанол, нафтил-2. Между тем удобнее это соединение индексировать по большей его части - нафталину: это может быть достигнуто помещением рядом двух названий - нафталина и этанола с цифровым локантом в качестве префикса. Это дает название 2-нафталинэтанол, что позволяет поместить его (без инверсии) в указателе под буквой Н. Однако при этом написании подразумевается, что в данном случае теряются два атома водорода, в то время как при составлении наименования по заместительной номенклатуре теряется лишь один атом водорода. Этот второй тип номенклатуры называется "соединительным".
(3) То, что при поверхностном взгляде кажется смешением заместительной и соединительной номенклатур, является общепринятой практикой использования префиксов для двухвалентных групп, таких как окси (-О-), карбонильной ( >С=О ) и тио (-S-). Предположим, что мы хотим трактовать группу СН3ООС - как заместитель: мы помещаем сперва наименование "метокси" перед двухвалентным радикалом "карбонил" и получаем "метоксикарбонил" (СН3О-СО-), причем в данном случае потери атома водорода не происходит. Затем мы можем ввести эту группу в качестве заместителя в родоначальное вещество, например в глицин (NH2CH2COOH), что будет сопровождаться обычной потерей одного атома водорода, и таким образом мы получим N-(метоксикарбонил)глицин H3СOOCNHCH2COOH.
(4) Для некоторых классов соединений допускаются старые названия, указывающие на их функцию, например: этиловый спирт, диэтиловый эфир, метилэтилкетон, уксусная кислота. Приверженец систематической номенклатуры предпочел бы, чтобы эти названия исчезли (за исключением кислот), поскольку имеются названия, более соответствующие современной номенклатуре. Однако старые названия очень живучи, что, по-видимому, кроме всего прочего, объясняется тем, что химики интересуются главным образом функциональными особенностями соединений, т. е. проявлением их химической активности. Согласно IUPAC, подобная номенклатура называется радикало-функциональной, так как функциональному названию класса (спирт, кетон и др.) предшествует наименование радикала (этил, уксусная и др.).
(5) В заместительной номенклатуре, называемой также "а"-номенклатурой, атом углерода в соединении "А" заменяют гетероатомом, что приводит к образованию вещества "Б". Такой подход упрощает название и узнавание веществ. В этом случае в названии вещества "Б" используют префикс, обозначающий присутствие (название) гетероатома. Такой префикс оканчивается на букву "а". Так, пиридин может быть назван азабензолом. Обычно этот способ наименования гетероциклов применяется, когда родоначальное соединение "А" имеет удобное тривиальное название. Распространение этого типа номенклатуры на алифатические соединения описано IUPAC и СА несколько различным образом, но применение ограничено относительно сложными соединениями во избежание возникновения привычных и ненужных выражений, таких как 3-оксапентан для диэтилового эфира СН3СН2ОСН2СН3.
(6) Лишь немногие реакции присоединения сохранились как основа для образования названий соединений, например: стиролоксид. Действительно, это одно из немногих аддитивных называний, которое допустимо в силу большей простоты по сравнению с систематическими названиями 1,2-эпоксиэтилбензол и 2-фенилоксиран. Такое название, как эргостериндибромид, также полезно как тривиальное, указывающее на родоначальное соединение, и кроме того, и на стереохимию соединения. В целом же аддитивной номенклатуры следует избегать: она не является частью современной номенклатуры. Конечно, имеется и исключение: термин "гидро" для присоединения водорода. Другой тип аддитивной номенклатуры применяется в случаях, когда объект названия повышает свою валентность, например пиридин образует пиридиноксид.
(7) Отщепление атомов отмечается в названиях лишь в редких случаях. Наиболее важными примерами являются суффиксы "-ен" и "-ин", применяемые для обозначения наличия двойной или тройной углерод-углеродной связи, возникающих в результате потери соответственно одной или двух пар атомов водорода. Реже такая потеря обозначается префиксом "дидегидро" (отщепление двух атомов водорода) или греческой буквой Δ. Другими префиксами, указывающими на отщепление, являются "ангидро" (отщепление воды) "нор" (потеря СН2-группы), "де" (СА) или "дез" (IUPAC/IUB) (потеря любой группы, например: де-N-метил).
(8) Многие циклические структуры имеют тривиальные наименования. В сложных случаях название строится путем соединения названий более простых частей соединения. Для названия таких соединений имеются также специальные системы, в которых особые слоги характеризуют тип циклической системы.
(9) Некоторые химические изменения могут быть описаны с помощью специальных терминов, например: "-лактон", "секо-", "-озид".
Ни один из описанных методов (принципов наименования) не может сам по себе всесторонне охватить все аспекты химии; некоторые из них альтернативны, например (1)/(2), (1)/(4) и (2)/(4), а некоторые имеют строго ограниченное применение. Наиболее общепринятой является простая заместительная номенклатура.
Уже здесь, по-видимому, уместно предупредить, что наименования кислот и их производных, альдегидов и аминов полностью не укладываются в рассмотренные выше принципы наименования.
Алфавитный порядок
Уже неоднократно указывалось, что префиксы вводятся в название соединения в алфавитном порядке. Сейчас это положение следует уточнить. Однако сперва следует разграничить два типа префиксов. Те, которые являются интегральной частью родоначального названия соединения, например: цикло-, изо-, окса-, бензо- и др., называют неотделяемыми. Те же, которые означают замещение, могут быть отделены от родоначального названия и помещаются после него при написании названия в инвертированной форме для индексации (указателей); такие префиксы называют отделяемыми. Например: Бензол, хлоро-; Бутанол-1, 3-метил-. Правила IUPAC разрешают такие префиксы как гидро- или указывающие на присоединение или образование гетеромостика (например, эпокси-) рассматривать либо как неотделяемые, либо как отделяемые. Однако СА, в котором требуется строгое единообразие, трактует префиксы "эпокси-" и "эпитио-" как неотделяемые, а "гидро-" и другие префиксы, указывающие на присоединение, - как отделяемые. Отделяемые префиксы располагаются в алфавитном порядке, при котором умножающие префиксы не учитываются. Сперва названия атомов и групп располагают в алфавитном порядке, а затем вставляют умножающие префиксы и локанты. Естественно, что при этом на разных языках возможны различия, как показывают приводимые примеры: о-бромохлоробензол - o-bromochlorobenzene; 3-метил-4-этилдекан - 4-ethyl-3-methyldecane; 3,3-диметил-1,1,1-трихлоропентан - 1,1,1 -trichloro-3,3-dimethylpentane.
Сложные радикалы образуют единый префикс, который включается в алфавитный порядок по первой букве наименования. Например: 1-(диметиламино)-4-(метиламино)-3-этилнафтойная-2 кислота; 1,5-бис(диметиламино)-4-хлоро-3-этилнафтойная-2 кислота. В случае идентичных префиксов с разными цифровыми локантами первым ставится префикс с младшим локантом. Например: 1-(2-этил-3-метилфенил)-8-(2-этил-4-метилфенил)нафталин
Как отмечалось выше, если в радикало-функциональном названии присутствуют два различных радикала, то они тоже пишутся в алфавитном порядке. Например: метилэтилкетон; бутилэтиловый эфир. Курсивы в алфавитном порядке не учитываются.
Нумерация
Принцип нумерации, применяемый для соединений и радикалов, одинаков, с единственным исключением, а именно: в соединениях наименьший номер дается главной (функциональной) группе (или группам); в радикалах он придается атому со "свободной" валентностью (валентностями), а все замещающие группы перечисляются в префиксах.
В номенклатуре понятие "наименьший локант" имеет специальный смысл. Если сравнить два или более возможных вариантов нумерации, составленных в восходящем порядке цифр, то "младшим" будет считаться тот, который в первом различающемся месте имеет меньший локант. Так, порядок локантов 1,1,7,8 младше, чем 1,2,3,4 [иногда считают, что наименьшей должна быть сумма цифр, но это неверно].
Правила IUPAC в этом вопросе рекомендуют для алифатических соединений приписывать наименьшие номера следующим элементам структуры, используя приводимые ниже признаки последовательно до тех пор, пока не будет достигнуто окончательное решение:
(1) главные группы;
(2) суммарная ненасыщенность (т. е. сумма двойных и тройных связей);
(3) двойные связи;
(4) тройные связи;
(5) атомы или группы, указываемые в префиксах;
(6) префиксы в порядке перечисления (по алфавиту)
Для циклических систем предписывается нумерация, которая подчас оставляет очень мало возможностей или совсем их не оставляет при выборе нумерации заместителей. Однако в тех случаях, когда выбор возможен, младшие номера даются в следующей последовательности:
(1) "обозначенный" атом водорода;
(2) главная группа;
(3) кратная связь в соединениях, название которых показывает частичное гидрирование (циклоалкены, пиразолины и им подобные);
(4) группа, обозначаемая префиксом;
(5) группа, обозначаемая первым по алфавиту префиксом. Простейшим случаем служит тот, в котором нумерация строго фиксирована еще в родоначальной структуре, что очень часто бывает у многих циклических соединений.
Если цикл дает возможность совершенно свободной нумерации, то нумерацию начинают от главной группы. Если в соединении имеется не одна главная группа, то их нумеруют чтоб главные группы получили наименьшие номера.
В гетероциклических соединениях начало нумерации определяет гетероатом, а направление ее - главная группа.
Если главная группа в соединении отсутствует, определящей является двойная связь, обозначаемая суффиксом "ен". Двойная связь может иметь и дополнительное значение в выборе направления нумерации, если главная группа не решает его однозначно. Следует иметь в виду, что ненасыщенность, не обозначенная суффиксом "ен", при этом не учитывается: префикс "гидро-" используется так же, как и другие заместители. Некоторые гетероциклические соединения после частичного гидрирования получают новые тривиальные названия и тогда ненасыщенность участвует в определении направления нумерации. При отсутствии в соединении главной группы или двойной связи, обозначаемой суффиксом "ен", порядок нумерации может определятся тройной связью.
При прочих равных условиях меньший номер дается префиксу, включаемому в название первым. Так правильными названиями будут: 1-бром-4-хлорбензол, 3-метил-6-этилоктан, 2-(диметиламино)-6-метилбензойная кислота, 1,2,3,4-тетрагидро-5,6,7,8-тетраметилнафталин.
Конъюнктивная (объединительная) номенклатура
Этот тип номенклатуры (ранее в СА называвшийся "аддитивной номенклатурой") может применяться тогда, когда циклическая система соединена через атом углерода или азота с атомом углерода алифатической цепи, несущей главную группу. В таких случаях за названием циклической системы без пробела следует название алифатической цепи и главной группы в суффиксе, например, 2-нафталинэтанол. Подразумевается, что в процессе образования связи теряются два атома водорода, а не один, как это происходит в заместительной номенклатуре. Локант, в приведенном выше примере цифра 2, указывает на положение 2 в ядре нафталина, а не в цепи этанола. В этой системе номенклатуры алифатическая составная часть является цепью, соединяющей циклическую систему и главную группу; все фрагменты, присоединенные к этой цепи, рассматриваются как заместители, и локантами для них служат буквы греческого алфавита, начиная от α-углеродного атома, связанного с главной группой. Заместители, как в алифатической цепи, так и в циклическом компоненте приводятся в префиксах. Если боковые цепи не идентичны, то одна (более простая) называется в префиксе.
Этот метод имеет ряд ограничений, различно определяемых IUPAC и СА. Так, правила IUPAC не разрешают применять этот тип номенклатуры к монозамещенным бензола, СА не применяет эту систему названия, если циклическая система связана с боковой цепью двойной связью. IUPAC и СА запрещают применение этого типа номенклатуры, когда алифатическая цепь ненасыщена или дифункциональна. Только правила IUPAC разрешают рассматривать группу -NHCOOH как алифатическую цепь. Дальнейшие детали для редких случаев можно найти в правилах IUPAC от 1970 г..
Функциональные группы
Алканы
Для построения названия алкана следует:
1. Найти главную цепь углеводорода, которой является самая длинная цепь, и назвать ее путем объединения умножающей приставки, соответствующей числу атомов углерода в цепи, с суффиксом "ан". Исплючение представляют названия первых четырех членов ряда: метан CH4, этан CH3CH3, пропан CH3CH2CH3 и бутан CH3(CH2)2CH3.
Перед названием неразветвленного углеводорода иногда приписывают курсивную букву "н-" (нормальный), подчеркивая этим линейный характер молекулы.
Если есть несколько цепей одинаковой длины, то предпочтение последовательно отдается цепи:
- в которой имеется наибольшее количество ответвлений;
- в которой заместители имеют ниаменьший набор локантов;
- которая имеет наибольшее количество атомов углерода в наиболее коротких ответвлениях;
- которая имеет наибольшее количество разветвленных боковых цепей.
2. Последовательно пронумеровать атомы углерода главной цепи, начиная с ближайшего к разветвлению конца. Если первые разветвления имеются на одинаковом расстоянии от обоих концов цепи, то нужно составить две возможных последовательности локантов и выбрать наименьшую.
3. Назвать замещающие группы (боковые цепи) в соответствии с числом имеющихся в них атомов углерода, записать их в алфавитном порядке перед названием главной цепи и указать их положение, поставив перед каждой группой номер атома главной цепи (локант), с которым она связана. Если имеются две или несколько одинаковых групп, то перед соответствующим префиксом следует использовать умножающую приставку; одинаковые локанты в этом случае пишутся через запятую.
Согласно правилам IUPAC префикс "изо", обозначающий терминальную группу (СН3)2СН-, применяется только для родоначальных алканов С4-C6, префикс "трет-" - только для алкилов С4 и С5, префикс "втор-" - только для втор-бутила, но не для всех аналогичных углеводородных остатков. Префикс "нео" применим только для неопентана С(СН3)4 (и его радикала). Следует напомнить, что "трет-" и "втор-" пишутся курсивом, через дефис, в то время как "изо" и "нео" пишутся слитно и обычным (прямым) шрифтом. В тех случаях, когда это требуется для указателей, буква "н-", означающая "нормальный" пишется курсивом и отделяется дефисом (однако применять ее следует только в случаях, когда это необходимо подчеркнуть). В указателях СА для названия алканов такие префиксы не применяются: например, неопентан С(СН3)4 там называют так: Пропан, 2,2-диметил- (Propane, 2,2-dimethyl-).
Алкены и алкины
Систематические названия алкенов образуются из соответствующих названий алканов путем замены суффикса "ан" на "ен" и указанием положения двойной связи в цепи с помощью локанта. В качестве главной цепи выбирается наиболее ненасыщенная (не обязательно самая длинная!). Нумерация начинается с конца цепи, который ближе к двойной связи. В полиенах для указания количества двойных связей к суффиксу "ен" добавляют умножающие приставки (перед ними для благозвучности добавляют соединяющую букву "а"), а цепь нумеруют так, чтобы двойные связи были обозначены наименьшими локантами.
Названия алкинов образуются из соответствующих названий алканов путем замены суффикса "ан" на "ин" и указанием положения тройной связи в цепи с помощью локанта. Правила выбора главной цепи и начала нумерации такие же как для алкенов.
Оба эти суффикса могут находиться в одном наименовании ("-ен" перед "-ин"), например: бутен-1-ин-2, гексадецен-2-диин-5,7-ол-4.
Соединения любой длины, содержащие две двойные связи разделенные одинарной, называют конъюгированными (сопряженными); о соединениях, содержащих тройную и двойную связь разделенную одинарной, говорят, что они содержат смешанные конъюгированные связи, а о соединениях, содержащих две и более двойные связи не разделенные одинарной, говорят, как о кумулятивно ненасыщенных, их называют кумуленами и нумеруют, как обычно, например: СН3СН=С=СН2 бутадиен-1,2.
Для алкенов и алкинов допускаются следующие тривиальные названия: ацетилен (сист. название этин) CH≡CH, аллен (сист. название пропадиен) CH2=C=CH2.
Циклоалканы
Номенклатура циклоалканов и их ненасыщенных производных очень сходна с номенклатурой неразветвленных алканов, отличаясь лишь префиксом "цикло-"; все заместители, присоединяемые к циклу, именуются как таковые, а нумерация осуществляется в соответствии с принципами, описанными выше.
Основная проблема заключается в том, какой фрагмент взять в качестве родоначального названия: цепь или цикл. В этом случае рекомендуется руководствоваться двумя критериями: а) максимальная замещенность фрагмента и б) размер фрагмента. В соответствии с этими критериями основной фрагмент выбирают следующим образом:
- в углеводороде, содержащем несколько цепочек, присоединеных к циклу, за основу берется цикл,
- в углеводороде, содержащем несколько циклов, присоединенных к цепи, за основу берется цепь,
- если цикл по размеру больше цепи, за основу, как правило берется цикл,
- если цепь по размеру больше цикла, то за основу, как правило, берется цепь.
Нумерация насыщенного цикла как основного фрагмента производится таким образом, чтобы заместители получили наименьший набор локантов. При выполнении этого условия и при наличии выбора меньший локант приписывается тому заместителю, который стоит первым по алфавиту. Следует иметь в виду, что нумерация цикла в русском названии может отличаться от его нумерации в английском названии.
Ароматические углеводороды
Правила IUPAC следуют общей практике; они разрешают использовать тривиальные названия для семи родоначальных углеводородов (бензол, толуол, ксилолы, мезитилен, стирол, кумол, цимолы). СА из тривиальных названий использует только бензол (benzene); все остальные называются как замещенные бензола. Родовое название ароматических углеводородов - арены.
Крайне реакционноспособный, но не выделяемый интермедиат бензола с тройной связью принято называть дегидробензолом, от него производят названия производных и аналогов.
Префикс "би-" издавна применялся в американской практике для обозначения прямого соединения двух одинаковых циклических систем, как это имеет место в соединении C6H5-C6H5 которое ранее в европейской практике называли дифенилом. IUPAC давно принял, как правило, префикс "би-" (вместо "ди-") в подобных случаях, и этот префикс теперь широко используется. Этот префикс исключительно удобен для описания "сдвоенных групп" (исключая бицикло, см. ниже). Однако правила IUPAC разрешают сдваивание как наименований радикалов, что дает название типа "бинафтил", так и молекул, что дает название типа "бинафталин". В последнем случае, как и в конъюнктивной номенклатуре, префикс "би-" подразумевает потерю двух атомов водорода. В настоящее время сдваивание наименований молекул стало предпочтительным почти повсеместно, за исключением наименования бинафтила и бифенила, которые давно укоренились. Отметим, что радикал С6Н5-С6Н4 называют бифенилилом (по правилам образования названий радикалов: второе "-ил" является характерным окончанием радикалов). В нумерации места соединения получают возможно меньшие локанты.
"Би"-номенклатура относится только к незамещенным соединениям; предполагается, что могут быть сдвоены только родоначальные соединения. Например, согласно правилам IUPAC, соединение HOOC-C6H4-C6H4-COOH следует назвать бифенилдикарбоновой-4,4' кислотой, а не п,п'-бибензойной кислотой, как ранее называли эту структуру американские химики.
Для более протяженных ансамблей циклов применяют префиксы: 3 - "тер-", 4 - "кватер-", 5 - "квинкви-", 6 - "секси-", 7 - "септи-", 8 - "окти-", 9 - "нони-", 10 - "деци", 11 - "ундеци-", 16 - "гексадеци-", 40 - "тетраконти-" и т. д., за ними идет название исходной молекулы (например: тернафталин, кватерпиридин и др.), но вновь с исключениями: терфенил, кватерфенил и т. д. В ансамблях из одинаковых звеньев локанты без штрихов присваиваются одному из терминальных звеньев, ближайшее следующее звено нумеруется локантами с одним штрихом, следующее - с двумя штрихами и т. д. Как всегда, места соединения получают возможно меньшие локанты, и это правило не меняется от появления суффикса, т. е. группа СОOН в бифенилдикарбоновой-4,4' кислоте считается находящейся в положении 4 и 4', а не 1 и 1'.
Полициклические углеводороды
Номенклатура полициклических углеводородов, равно как и гетероциклических соединений, значительно сложнее, так как здесь встречается множество соединений с самыми различными структурами. Химик должен быть знаком с основными принципами, которые только и могут быть приведены здесь. Существует довольно большой список тривиальных наименований, из которых методом конденсирования строят названия структур, имеющих еще более сложные скелеты. Имеется и другой метод построения наименований полициклических соединений (бициклических систем), независимый от метода конденсации и списка тривиальных наименований. Кроме того, имеется несколько методов, применяемых для особых типов соединений. Ими заняться следует именно в перечисленном порядке, но сперва лучше рассмотреть общие методы записи формул и нумерации ароматических полициклических систем.
(1) Если только возможно, циклы должны изображаться с двумя вертикальными сторонами (трехчленный цикл - с одной вертикальной стороной).
(2) Как можно больше циклов следует изображать в горизонтальном ряду, независимо от их размера.
(3) По-возможности, большая часть оставшихся циклов должна размещаться в правом верхнем квадранте, и по-возможности, меньшая часть - в левом нижнем квадранте (за центр принимается средний цикл горизонтального ряда).
(4) Правильно ориентировав формулу, нумерацию начинают с правого верхнего цикла от первого атома углерода, не участвующего в слиянии с другими циклами, и ведут нумерацию по часовой стрелке по периметру молекулы. Атомы, общие для двух циклов (узловые), получают локант предыдущего атома с добавлением курсивной буквы латинского алфавита: а, b, с и т. д. Для более редких случаев порядок нумерации определяется дополнительными правилами. Для антрацена и фенантрена нумерация давно устоялась и не подчиняется вышеприведенным правилам.
Некоторые циклические структуры содержат звено СН2. Для хорошо известных соединений, таких как инден и флуорен, положение СН2-группы однозначно и считается нормальным. Во всех остальных случаях положение СН2-группы фиксируется буквой Н, написанной курсивом, которой предшествует цифровой локант, обозначающий ее место в цикле. Если СН2-группа в молекуле флуорена находится в необычном положении, то она фиксируется, как сказано выше, например 3H-флуорен. Такой водород называют "обозначенным водородом". СА теперь во всех случаях применяет "обозначенный водород", поэтому, в СА: 1H-инден, 9H-флуорен.
Как и обычно, гидрирование обозначают префиксами "гидро-" (включая "пергидро-" для полностью гидрированных соединений), однако для ряда частично гидрированных соединений правила IUPAC разрешают использовать тривиальные названия (не применяемые в методе конденсирования и не используемые в указателях СА).

Метод конденсирования (аннелирования) при построении названий углеводородов
Названия ароматических углеводородов, не включенных в список разрешенных IUPAC, составляются методом конденсирования, по правилам, принятым IUPAC и СА. Эти правила охватывают очень много ситуаций.
(1) В качестве основного компонента выбирается тривиальное название наибольшей подходящей структурной единицы. В выбранной структуре, начиная от связи 1,2 все грани по периметру обозначаются строчными (малыми) курсивными буквами латинского алфавита: а, b, с и т. д. Полное название составляется подстановкой названия причлененной структуры (со связкой "о") перед названием основы. В квадратных скобках обозначается порядок сочленения: для этого указывают локанты атомов причлененной структуры, участвующих в конденсировании, и буквенное обозначение грани основной структуры. Затем, если это необходимо, формула может быть переориентирована в соответствии с правилами (1) - (3), описанными выше, и перенумерована в соответствии с правилом (4).
(2) 9H-нафто[1,2,3-cd]перилен, является примером трехточечного конденсирования.
(3) Для бензо-производных содержимое квадратных скобок может быть сокращено и ограничено лишь указанием грани или граней старшего компонента, как например у бенз[а]антрацена.
(4) Сокращенные наименования применяются для префиксов бензо-, нафто-, антра- (обратите внимание на это "а"), фенантро-, аценафто- и перило-, но не для прочих.
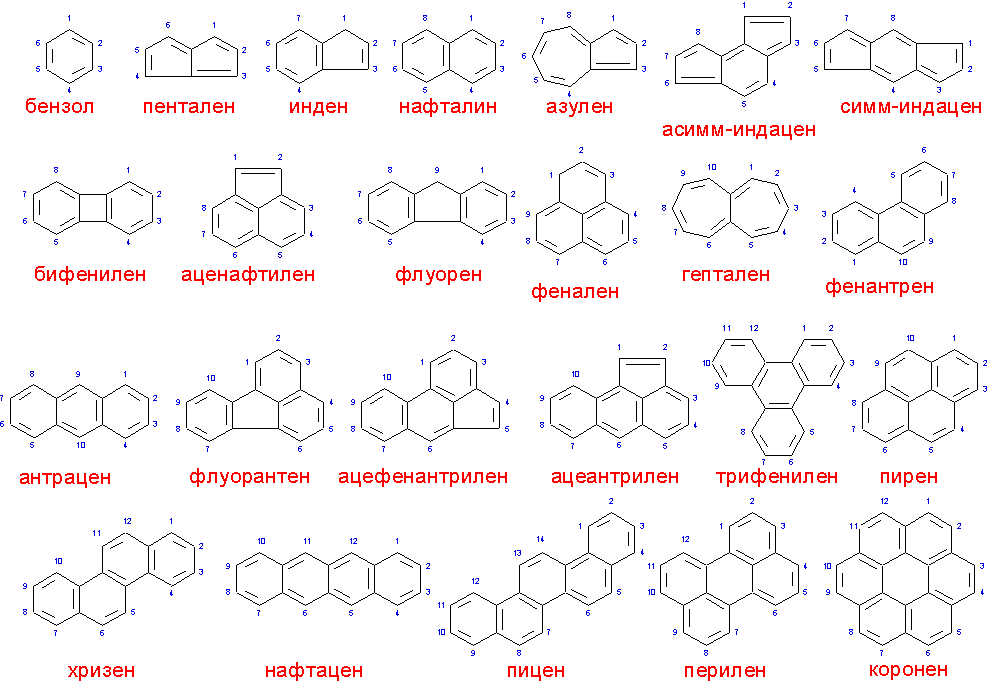
(5) Окончательное название относится к соединению, содержащему максимальное число некумулированных двойных связей; так, в индено[1,2-а]индене, полученном при слиянии двух молекул индена, группа СН2 исчезает. 
(6) Продукты частичного гидрирования обозначаются префиксом "гидро-" с умножающей приставкой, при исчерпывающем гидрировании - префиксом "пергидро-".
(7) Циклоалкеновые кольца обозначаются префиксами "циклопента-", "циклогепта-", "циклоокта-" и т. д., которые относятся к кольцам, содержащим максимальное число некумулированных двойных связей. Так образуются, например, названия соединения 1H-циклопентациклооктен (тотчас следует заметить, что для стероидов применяется особая нумерация, не соответствующая рассмотренным выше правилам IUPAC).
(8) Гласная "о", указывающая на слияние, часто отбрасывается перед следующей гласной, даже если последняя находится после квадратных скобок, как это было отмечено, например, в названии бенз[а]антрацена.
(9) Для локантов, характеризующих места слияния, применяются квадратные скобки, чтобы не спутать их с локантами окончательной нумерации соединения.
Номенклатура мостиковых углеводородов
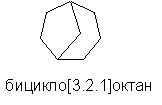 Первоначально эта система номенклатуры была разработана для соединений, содержащих мостиковые карбоциклические системы, преимущественно насыщенные. При этом образуются два или более кольца, обладающие двумя или большим числом общих атомов. Типичными примерами служат бицикло[3.2.1]октан и бицикло[2.2.1]гептадиен-2,5. Однако этот метод применим также и для более ненасыщенных систем.
Первоначально эта система номенклатуры была разработана для соединений, содержащих мостиковые карбоциклические системы, преимущественно насыщенные. При этом образуются два или более кольца, обладающие двумя или большим числом общих атомов. Типичными примерами служат бицикло[3.2.1]октан и бицикло[2.2.1]гептадиен-2,5. Однако этот метод применим также и для более ненасыщенных систем.
Названия бициклических соединений строятся следующим образом. Подсчитывают число атомов углерода в каждом мостике соединяющем узловые атомы, и записывают их в квадратных скобках, от большего к меньшему, разделяя цифры точками. Перед скобкой ставят префикс "бицикло-", а за скобкой - название алкана, содержащего такое же число атомов углерода, что и рассматриваемая бициклическая система (включая узловые и мостиковые углеродные атомы). Мостик может не содержать атомов углерода, других, чем узловые - тогда в скобках ставится 0. Нумерацию структуры начинают от одного конца мостика (начиная с узлового атома), ведут к другому по более длинному пути и далее продолжают до возвращения по более короткому. Последними нумеруют мостиковые атомы углерода. Ненасыщенность указывают обычным образом. Этот метод построения названий часто распространяют на трициклические и более сложные мостиковые структуры; он представляется единственным общим методом наименования таких и еще более сложных полициклических структур. В целях распространения этого метода для наименования более сложных структур разработаны дополнительные правила IUPAC.
Для систем содержащих, больше двух циклов используется префиксы трицикло-, тетрацикло-, пентацикло- и т.д. Считают, что полициклическая система содержит столько циклов, сколько связей следует нарушить, чтоб превратить эту в систему в соединение с открытой цепью. После слова цикло, помещают цифры, указывающие на число атомов углерода: в двух мостиках основного кольца, в основном мостике, во вторичных мостиках. Местоположение вторичных мостиков обозначают показателями у цифр, указывающих число атомов углерода, входящих в эти мостики. Вторичные мостики нумеруют в убывающем порядке. Нумерацию любого мостика начинают от уже пронумерованной части, от узла, обозначенного самым большим номером. Если возможен выбор, порядок нумерации определяют на основании следующих критериев:
а) основное кольцо должно содержать как можно больше атомов углерода, два из которых являются узловыми атомами основного мостика;
б) Основной мостик должен быть как можно больше;
в) Основное кольцо должно быть разделено основным мостиком как можно более симметрично;
г) цифры-показатели, обозначающие положения других мостиков, должны быть как можно более низкими по значению.
В правилах ИЮПАК 2013 года названия адамантан и кубан оставлены в качестве предпочтительных.
Ароматические мостиковые углеводородные системы
Для названия соединений, содержащих мостик в ароматической системе (они получаются частично гидрированными), применяют совершенно иной подход, нежели тот, что описан выше для обычных мостиковых систем. Мостик называют от названия соответствующего углеводорода, связывающего узловые атомы (но не от названия радикала), с добавлением терминальной буквы "о"; например: -СН2- метано, -СН2СН2- этано, -С6Н4- бензоло. Это название в префиксе присоединяют к названию циклической системы, содержащей мостик. Например: 9,10-дигидро-9,10-этаноантрацен и 5,10-дигидро-5,10-о-бензоло-5H-бензо[b]флуорен.
Даже к таким относительно простым случаям следует сделать два замечания. В обоих примерах, как и почти во всех остальных, кольцо, содержащее мостик, гидрировано, каждый конец мостика содержит по одному атому водорода, так что полное название должно содержать префикс "гидро-". И второе: мостик нумеруется, начиная с конца, примыкающего к атому, ранее имевшему наибольший номер. В более сложных случаях следует обращаться к правилам IUPAC.
Спираны
Спиранами называют соединения, в которых два цикла обладают одним общим атомом углерода. В результате разработки правил IUPAC и общего прогресса в вопросах номенклатуры, название этого класса соединений может быть упрощено сведением к двум следующим простым правилам.
Названия соединений, в которых два карбоцикла объединены в спирановую систему, начинается префиксом "спиро-", затем, после квадратных скобок, следует название углеводорода, содержащего суммарное число атомов углерода всей данной системы. В квадратных скобках содержатся цифры, указывающие число членов сперва меньшего цикла, затем, после точки - большего (общий спирановый атом углерода при этом не учитывается). Полная нумерация атомов молекулы начинается с ближайшего к спирановому атома углерода в меньшем цикле и идет по периметру молекулы. Например: спиро[4.5]декадиен-1,6.
Диспиро[5.2.7.2]гептадекан - служит примером распространения этого метода на более сложный случай формулы (CH2)7C(CH2CH2)2C(CH2)5. В скобках для него указано: число С-атомов меньшего крайнего цикла (5) (как и ранее, без учета спиранового С-атома), затем число С-атомов до следующего спиро-атома (2), число С-атомов другого крайнего цикла (7) и снова число С-атомов до первого спиро-атома (2). Для диспиро-, триспиро- и более сложных спиросоединений числа перечисляются, начиная с меньшего крайнего кольца в направлении другого крайнего кольца и затем назад к первому по другим связывающим цепочкам. Для триспиро- и более, при перечислении цепочек, связывающих спиро-атомы, когда спиро-атом встречается второй раз, его локант приводится в виде надстрочного индекса к числу, показывающему количество атомов в соответствующей цепочке. Нумерация атомов производится начиная с наименьшего крайнего цикла, причем спиро-атомы должны получить, по возможности наименьшие локанты.
Если один или более компонентов содержат конденсированную полициклическую систему, то применяют иной метод, например 1,1'-спиробиинден и спиро(циклопентан-1,1'-инден).
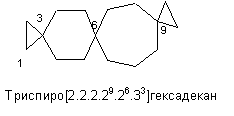
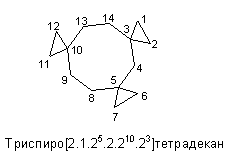
Циклы с боковыми цепями
Циклический углеводород с короткими боковыми цепями обычно рассматривают как замещенное циклическое соединение, например: гексаметилбензол. Простая циклическая система с длинной боковой цепью по правилам IUPAC рассматривается как замещенный алифатический углеводород, например: 1-фенилдекан. Естественно, что сложные циклические системы рассматриваются как родоначальные структуры даже в том случае, когда они содержат длинную боковую цепь, например: 1-додецилпирен. Для промежуточных случаев правила IUPAC разрешают произвольный выбор родоначальной структуры, в то время как СА всегда отдает предпочтение циклу.
Наличие в боковой цепи ненасыщенности побуждает правила IUPAC отдавать предпочтение алифатическому углеводороду, как родоначальной структуре, например: 1-(нафтил-2)гексадиен-1,3, который, однако, по СА следует называть 2-(l,3-hexadienyl)naphtalene. Цепи, замещенные двумя или более циклическими радикалами, удобнее трактовать как родоначальные, например 2-(нафтил-2)-4-фенилгексан более простое название, чем 2-(1-метил-3-фенилпентил)нафталин. Однако следует всегда помнить, что присутствие в молекуле главной группы имеет решающее влияние для выбора метода наименования.
Фаны
Сложные полициклические соединения, состоящие из циклов и цепей, объединенных в линейные структуры, называют фанами, а объединенных в циклические структуры — циклофанами. В принципе, все эти структуры могут быть названы как мостиковые полициклические соединения. Однако при таком подходе (используется в Chemical Abstracts) даже близкородственные соединения часто имеют абсолютно непохожие названия, в которых без «расшифровки» не видны важные составные части молекулы. Поэтому для такого сорта соединений была разработана специальная номенклатура, лишенная указанных недостатков.
Номенклатура фанов представляет собой адаптацию заместительной номенклатуры к построению названий сложных органических соединений из названий составных частей молекулы. Операция упрощения представляет собой первый шаг к формированию родоначального названия фана, при которой важные с точки зрения номенклатуры сегменты сложной циклической структуры заменяются одним «атомом», называемым суператомом. Соответствующие локанты называются локантами суператомов. Структура, где вместо циклов в цепи находятся суператомы называется упрощенным скелетом фана, который определяет упрощенное скелетное название; локанты в этом скелете, называемые скелетными локантами, являются первичными локантами для фанового родоначального гидрида. Многоатомные структурные единицы, замещающие суператом при процедуре усложнения, называют амплификантами. В родоначальном названии фана их выражают с помощью амплификационных префиксов. Каждый амплификант имеет нумерацию соответствующей циклической системы.
Новые названия классов соединений
Недавно предложенные названия подразделяются на два типа: те, которые предложены для больших групп соединений, таких как углеводы или стероиды, названия которых широко используются соответствующими специалистами, и те, систематические названия которых даже для специалистов с первого взгляда не разъясняют истинное строение молекулы. Конечно, существуют и такие совершенно необычные и ни с какой стороны не отражающие структуру соединения названия.
Иногда название одного индивидуального соединения распространяется на целый класс его аналогов, если выясняется, что они представляют значительный интерес. Таким примером могут служить циклофаны - наименование присвоенное в качестве общего для целого класса соединений. Его типичным представителем является соединение, систематическое название которого 1,1': 4,4'-бистриметилендибензол. Для него было предложено более удобное название п,п'-[3.3]-циклофан (по СА: [3.3]paracyclophane). Само собой разумеется, что для иначе связанных алкиленовых групп, а также для орто- и мета-изомеров в названия вносятся небольшие соответствующие изменения. Для случаев, когда бензольные ядра заменяются другими ядрами, когда алкиленовые цепочки содержат гетероатом, когда аналогичным образом связано более чем два ядра или имеется более чем две цепочки, - предложены различные варианты построения названий этих соединений. Эта развивающаяся область еще требует систематизации и будет обсуждаться рабочей группой IUPAC.
Гетероциклические соединения
Среди всех классов органических соединений гетероциклические соединения обладают наибольшим разнообразием структурных типов, и поэтому наиболее сложной номенклатурой. Ниже приведен общий обзор принципов номенклатуры этих соединений.
Даже если не считать алкалоидов, имеется необычайное множество тривиальных или полутривиальных названий гетероциклических соединений. В списке правил IUPAC содержится 47 названий гетероциклических систем, которые могут быть использованы при составлении сложного названия методом конденсации, и 14 гидрированных систем, которые не используют в этом методе.
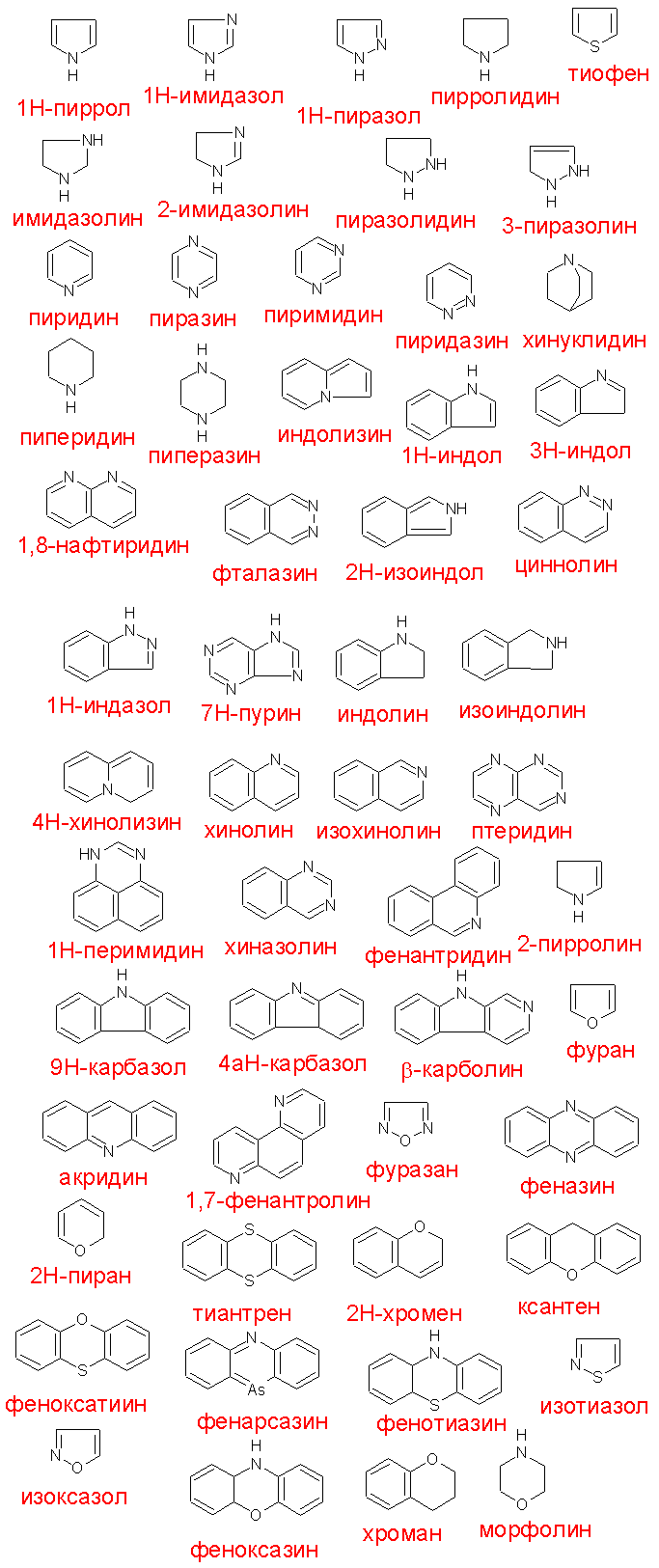
Во всех гетероциклических системах узловой гетероатом получает свой локант. Альтернативные названия, принятые в указателях СА, точно фиксируют все "обозначенные" атомы водорода вместо того, чтобы оставлять их подразумеваемыми, как это делается в некоторых названиях по IUPAC.
Кроме тривиальных названий в химии гетероциклических соединений широко применяется расширенная система Ганча-Видмана. По этой системе гетероатомы обозначаются слогами (префиксами), оканчивающимися буквой "а" (окса-, тиа-, селена-, аза-, фосфа- и т.д.) (буква "а" опускается перед следующей гласной буквой) и сопровождаются другим слогом, указывающим на размер цикла.
В некоторых случаях последний слог несколько видоизменяется, чтобы отразить степень гидрирования цикла, однако чаще для этого используется префикс "гидро-".
Большинство суффиксов для обозначения величины цикла образуется отделением нескольких букв от соответствующего числительного: "-ир", от "три" (трехчленный цикл), "-ет" от "тетра", "-еп" от "гепта", "-ок" от "окта", "-он" от "нона" и "-ек" от "дека", и только "-ол" для пятичленного и "-ин" для семичленного циклов являются оригинальными окончаниями в этой системе номенклатуры (образовались от названий наиболее распространенных азотистых гетероциклов: пиррол и пиридин).
Для шести- и более членных гетероциклов терминальное "-ин" означает ненасыщенность азотсодержащего цикла; суффикс "-идин" используется как окончание полностью гидрированных трех- и пятичленных азотсодержащих циклов, "-ан" - для полностью гидрированных гетероциклов, не содержащих азота.
Если в цикле содержится более одного гетероатома, они указываются в порядке, определенном обратным порядком групп таблицы Менделеева и в порядке увеличения атомного номера, например: "оксатиа", "тиаза", "оксаза" (обратите внимание на пропуск буквы "а" в "тиаза" и "оксаза").
Локанты предшествуют полученным названиям. Гетероатом, находящийся в таблице Менделеева в группе с большим номером и имеющий меньший атомный номер должен получить наименьший из возможных номеров, и далее так же поступают и с другими гетероатомами. Примерами здесь могут служить названия: 1,3-тиазол, 1,2,4-триазин и 1,2,4-тиазафосфол (вместо 1,3-тиазол обычно пишут просто тиазол).
"Обозначенный водород" в группе СН2 обычно фиксируют так же, как и в случае карбоциклических соединений, например: 6H-1,2,5-тиадиазин.
Метод конденсирования при построении названий гетероциклов
Названия гетероциклов могут быть сконденсированы с названиями циклических углеводородов или других гетероциклических систем по методу, аналогичному описанному ранее для углеводородов. Естественно, что при этом возникают некоторые особенности. При конденсировании названий гетероциклов используют следующие сокращения: фуро, имидазо, пиридо, хино и тиено. Названия других гетероциклов при слиянии не сокращаются. Если гетероциклическая структура ориентирована так, как это характерно для соответствующей карбоциклической системы (без гетероатомов), то гетероатом в гетероциклической структуре должен получать наименьший возможный номер. Однако если гетероатом является узловым, то нумерацию ведут обычным путем, но без использования для гетероатома латинских букв а, b, с и др. Это положение иллюстрирует пирано[3,4-b]хинолизин.
Как и в случае карбоциклических соединений, квадратные скобки используются для выделения локантов, относящихся к исходным компонентам, а не к конечному названию. Примерами могут служить названия: антра[2,1-d]тиазол и пирроло[2,3-с]карбазол. Последнее соединение служит также иллюстрацией примера потери двух атомов водорода (одного из пиррольного цикла, а второго - из карбазольного) для образования системы с максимальным числом некумулированных двойных связей.
В этой области возникает много сложных, запутанных проблем, в основном связанных со слиянием компонентов и нумерацией. Ученым, работающим в данной области, следует тщательно проштудировать все детали раздела В правил IUPAC, книгу The Ring Index, а если понадобиться, то и книгу Parent Compound Handbook.
При конденсировании гетероциклического компонента, названного по системе Ганча-Видмана, с бензольным ядром (что, к счастью, встречается достаточно часто) возникают системы называть которые значительно проще. Примерами могут служить названия: бенз-1,2-оксатиин и бенз-2,1-оксатиин.
Все конденсированные гетероциклические структуры, содержащие меньше максимально возможного числа некумулированных двойных связей, должны в своем наименовании иметь префикс "гидро-", которому предшествуют локанты, указывающие положение гидрированных двойных связей, а после него положение "обозначенного водорода", например: 3,4-дигидро-2H-1,4-бензоксазин.
Заменительная номенклатура
Префиксы, обозначающие гетероатомы по расширенной системе Ганча-Видмана, могут быть использованы и для общей заменительной номенклатуры. Достаточно перед наименованием углеводорода поставить префикс соответствующего гетероатома и цифровым локантом обозначить, какой из атомов углерода заменен на гетероатом. Получаемые таким путем названия часто более удобны, особенно для соединений, содержащих различные типы гетероатомных циклов, или для сложных циклических систем. Так, на примере 8H-7-тиа-1,9-диазафенантрена можно видеть, что таким путем сохраняется привычная нумерация, и, кроме того, гетероатомы получают наименьшие локанты.
Применяя этот тип номенклатуры, в качестве родоначального соединения следует выбирать соответствующий углеводород, а не гетероцикл, содержащий меньшее число гетероатомов, так как это может привести к множественности названий. Например, в этом случае 8H-7-тиа-1,9-диазафенантрен мог бы получить название 4H-3-тиа-7-азафенантридина и др. Для заменительной номенклатуры гетероциклов весьма плодотворно могут быть использованы также названия типа бицикло-, трицикло- и т. д.
Гетеромостики
В ароматических и других сложных системах гетеромостики успешно могут быть обозначены по эпи-системе. Префикс "эпи-" (перед гласной укорачивается: "эп-") сопровождается названием мостикового радикала [в противоположность методу названия мостиковых углеводородов, где указывается название связывающего (мостикового) углеводорода]. Таким путем для мостикового кислорода -О- получается префикс "эпокси-", для мостика -OO- "эпидиокси-", для -S- "эпитио-", для -NH- "зпимино-". Следует заметить, что префикс "дигидро", как и для мостиковых углеводородов, вместе с префиксом "эпи-" являются частью основной структуры, т. е. являются неотделяемыми. Поэтому они не включаются в алфавитный порядок обычных префиксов, а остаются на своем месте.
Радикалы
Многие старые названия радикалов одобрены правилами IUPAC и до сих пор используются большинством химиков. Однако в правилах СА для указателей после долгих обсуждений введена большая систематичность, поэтому ниже рассматриваются оба варианта. Названия, принятые в СА, кажутся логически проще (но не короче) и, по-видимому, будут привлекать все большее внимание, шире использоваться.
Ациклические радикалы. Как хорошо известно, названия одновалентных радикалов производятся от названий алканов, алкенов и алкинов путем замены суффиксов "-ан", "-ен" или "-ин" на "-ил", "-енил", или "-инил" соответственно, например: метил или бутенил-2. Правилами IUPAC разрешены следующие несистематические названия радикалов: СН2=СН- винил и СН2=СНСН2- аллил. СА не признает этих исключений.
Аналогично, правила IUPAC (но не СА) разрешают использование префикса "изо-" для немногих незамещенных радикалов [для С3-С6, например: (СН3)2СН- изопропил], использование префикса втор- [только для СН3СН2СН(СН3)- втор-бутил], префикса нео- [только для (СН3)3ССН2- неопентил] и префикса трет- [для (СН3)3С- трет-бутил и СН3СН2С(СН3)2- трет-пентил].
Согласно правилам IUPAC при обозначении положения заместителей в цепи радикала, атом, которым он присоединяется к основной части молекулы, получает наименьший из возможных номеров или, по другому методу, от этого атома начинают цепь радикала (т. е. этот атом получает номер 1), и соблюдают обычный порядок: наибольшая ненасыщенность, замещенность или длина (По правилам СА приоритет имеет наиболее длинная цепь). Например, гептан C7H16 дает радикалы: СН3(СН2)5СН2- гептил, СН3(СН2)4СН(СН3) - гептил-2, или, по второму методу, 1-метилгексил, и т. д. Правилами IUPAC разрешено тривиальное название изопропенил для радикала СН2=С(СН3)-.
Радикалы типы CH3(CH2)xCH= получают суффиксы "-илиден" (вместо "ан"), а более редкие радикалы СН3(СН2)xС≡ называют алкилидинами.
Согласно правилам IUPAC как радикал -СН2-, так и СН2= называют метиленом, -СН2СН2- этандиилом (этиленом), а -СН(СН3)СН2- пропандиилом-1,2 (пропиленом); высшие неразветвленные дирадикалы -СН2(СН2)xСН2- называют алкандиилами-1,х+2 (полиметиленами), например:
-СН2(СН2)3СН2- пентадиил-1,5 (пентаметилен). (Отметим здесь, что углеводород СН3СН=СН2, согласно систематической номенклатуре называют пропеном, но не пропиленом.) Из приведенных выше названий СА применяет только метилен и использует суффикс "-диил" для обозначения таких радикалов, как -СН2СН2СН2- пропандиил-1,3 и -СН(СН3)СН2- 1-метилэтандиил (но не пропандиил-1,2 в последнем случае), поскольку нумерация должна быть начата с С-атома, связанного с метильной группой.
Аналогично называют ненасыщенные радикалы, например: -СН2СН=СНСН2- бутен-2-илен (IUPAC) или бутен-2-диил-1,4 (2-butene-l,4-diyl, CA).
Радикалы из циклических систем. Радикалы, образуемые карбоциклами, называют аналогично описанному для алканов и алкенов. Аналогично из наименований аренов производится родовое наименование ароматических радикалов - арилы. Общим правилом для всех прочих радикалов - производных циклических молекул, является добавление к названию соединения суффикса "-ил", "-илен" или "-диил", "-илиден", "-триил". Например, инденил, индендиил, азуленил, карбазолил, птеридил и изоксазолил.
Во всех случаях локанты, обозначающие свободную валентность радикалов (т. е. место присоединения), должны быть пo возможности наименьшими, поскольку это совместимо с любой фиксированной нумерацией системы. Они имеют приоритет над локантами кратных связей и любых заместителей.
Свободные радикалы
Свободные радикалы, образующиеся из алканов или циклических структур, получают те же названия, что и замещающие группы, например: СН3- метил, С6Н5- фенил. Электронодефицитная частица :СН2 и продукты ее замещения можно называть или метиленами, или карбенами, например: Cl2С: - дихлорметилен, или дихлоркарбен. Карбены - групповое наименование этого класса соединений.
Окончание "-ил" применяют для свободных радикалов даже в том случае, когда групповое название оканчивается на "-и", например: СН3О- метоксил (но не метокси); на "-ил" оканчиваются также названия свободных радикалов аминов, например: CH3NH· метиламинил и C5H10N· пиперидинил-1 (но не пиперидино). Для специалистов можно отметить также рекомендуемое IUPAC название СН3N: метиламинилен и его аналоги, а также гидразил для NH2NH·. Однако для CH3N: более привычно название метилнитрен (по аналогии с карбеном), независимо от того, имеет ли место синглетное или триплетное состояние.
Ионы
Названия анионов кислот образуются путем замены окончания "-вая кислота" на "-ат".
Анионы, образующиеся при отрыве протона (или протонов) от углерода, часто называют карбанионами. Конкретные названия карбанионов образуются путем добавления к названию исходного соединения суффикса "-ид" (или "-диид"). Например: СН3(СН2)3- бутанид-1, С6Н5- бензенид, дигидронафталиндиид-1,4.
За исключением тех случаев, когда можно прибегнуть к окончанию "-ий", номенклатура катионов значительно сложнее. Сперва следует отметить такие простые катионы, как H4N+ аммоний, H3S+ сульфоний, а также сходные гетероциклические катионы и их производные. Далее, это же окончание "-ий" может быть добавлено к тривиальному или систематическому названию соединения, которое образовало катион в результате присоединения протона, с добавлением в случае необходимости локанта. Типичными примерами могут служить: С6Н5NH3+ анилиний. Исключение составляет уроний.
Катионы, формально рассматриваемые как результат присоединения протона к ненасыщенным соединениям, называют, исходя из названий последних, также присоединением окончания "-ий" (в языках использующих латинский алфавит используется окончание -ium), например: СН3СН2+ этений, С6Н7+ бензолий.
Катионы, формально образуемые из свободных радикалов при потере электрона, могут называться, исходя из названий последних, например: СН3СО+ ацетилий, С6Н5+ фенилий; эту систему предпочитают в СА. Такие катионные структуры могут содержать делокализованные связи. Примером может служить катион С6Н7+ бензолий (дигидрофенилий); протонированная форма аллена может быть изображена структурой [СН2=СН=СН2] + - аллений-2 (пропенилий). Другой простой способ состоит в написании после названия исходного радикала слова "катион" (отделяют дефисом), например: этил-катион, аллил-катион (последний уже упоминался выше под названием пропенилий-иона). Иногда применяемый для СН3+ термин "карбоний" не санкционирован правилами IUPAC и не желателен логически (лучше применять название карбений). Возможно также присоединение протона к алкану с образованием такого необычного иона, как CH5+; в ожидании принятия решения относительно приемлимого официального правила его лучше всего обозначать как "протонированный метан". Групповое наименование "карбокатион" также не является официально принятым, но употребляется для обозначения соединений, содержащих положительно заряженный атом углерода.
При использовании в префиксе характерное для катионов окончание "-ий" меняется на "-ио-", например: 1-метил-4-(триметиламмонио)хинолинийдихлорид.
В заменительных названиях заряженный гетероатом обозначают префиксами "-оксониа-", "-азониа-" и "-тиониа-" вместо "-окса-", "-аза-" и "-тиа-". Это оказывается очень удобным для номенклатуры бициклов. Например, ион 1-этил-1-азониабицикло[3.3.0]октана. Для ознакомления с другими примерами следует обратиться к лравилам IUPAC.
Ион-радикалы
Катион-радикалы получают названия с окончанием "иумил", например: С6Н6+· бензолиумил, С9Н7N+· хинолиниумил.
В 2013 году было предложено использовать окончания "елид" для анион-радикалов и "елий" для катион-радикалов. Дианион-дирадикал бифенила будет называться 1,1'-бифенилдиелид, катион-радикал азулена - азуленелий. Если радикальная группа отделена от ионного центра используется порядок старшинства: радикал > аниона > катиона. Например, ·CH2CH2- будет называться этан-2-ид-1-ил.
Галогенпроизводные
Для названия галогенопроизводных очень удобна и широко применяется заместительная номенклатура с использованием в качестве префиксов названий "фторо-", "-хлоро-", "бромо-" и "иодо-" (в русском языке соединяющая буква о часто опускается), например: 2-хлорохинолин, 2,3-дихлоропропионовая кислота или 1-бромо-6-иодогексан. Однако для очень простых соединений, таких как СН3I, С6Н5СНСl2, СlС2Н4Сl, нередко используют радикало-функциональные названия, например метилиодид, бензилидендихлорид (но не бензальдихлорид) и этилендихлорид соответственно. Удобство этих названий состоит в том, что они ясно подчеркивают главную, по существу единственную, химическую особенность соединения. В отдельных случаях информативна и аддитивная номенклатура, особенно когда имеется или предполагается возможность присоединения атомов галогена по двойной связи, как в названиях этилендихлорид СlСH2СH2Сl, стиролдибромид С6Н5СНВrСH2Вr.
Если в исходном соединении все атомы водорода замещены каким-либо одним галогеном, то полнота замещения может обозначаться префиксом "пер-".
Вероятно в силу краткости и давней традиции применения, названия типа фтороформ, хлороформ и т. д. для структур CH(На1)3 продолжают использоваться и поныне, но распространение этой традиции на нитроформ для тринитрометана нежелательно. Для более сложных заместителей, содержащих галогены, приняты следующие префиксы: -IO "иодозил-", -IO2 "-иодил-", -СlO "хлорозил-", -СlO2 "хлорил-", -СlO3 "перхлорил-", -IХ2 "ди-Х-иодо-".
Катионы типа Х2Наl+ называют замещенным хлоронием, бромонием и т. д.
СOСl2 можно называть фосгеном, карбонилдихлоридом (СА: carbonic dichloride), C(Hal)4 - тетрагалогенметаном или тетрагалогенуглеродом.
Спирты и фенолы
Если ОН является главной группой, то спирты и фенолы обозначают характерным суффиксом "-ол", в противном случае - префиксом "гидрокси-". Как уже отмечалось, названия нафталиндиол-1,8 или хинолинол-8 правильнее, чем 1,8-дигидроксинафталин или 8-гидроксихинолин, хотя оба последних все еще встречаются в литературе.
СА и ИЮПАК 2013 сохраняют тривиальное наименование "фенол" (вместо систематического бензолол), но для всех прочих соединений этого класса используют систематические названия, например: 1,3-benzenediol, 1-naphthalenol, 9-antracenol. Однако нельзя сказать, что отказ от тривиальных названий встречает восторг у химиков.
В алифатических спиртах группа ОН, стоящая в главной цепи, обозначается суффиксом "-ол", например: пентанол-1 и пентандиол-1,3. Присутствие ОН-группы может определять выбор главной цепи.
За исключением указателей СА, иногда еще используются радикало-функциональные названия для соединений этого класса, особенно для простых соединений алифатического ряда, например: метиловый спирт или бензиловый спирт. Соединение (СН3)3СОН проще называть трет-бутиловым спиртом, чем 2-метилпропанолом-2. Следует отметить, что название трет-бутанол некорректно, так как в нем суффикс "-ол" присоединен к несуществующему соединению: трет-бутану. Соединение (СН3)2СНОН в промышленности называют изопропанолом, но с точки зрения систематики это также некорректное название.
Естественно, что в такой обширной и давно известной области, как спирты и фенолы, имеется такое множество тривиальных названий, что их привести все здесь просто невозможно. Однако некоторые из них должны быть отмечены.
Ряд алкоксибензойных кислот и алкоксибензальдегидов имеет хорошо известные тривиальные названия, например: п-СН3ОС6Н4СООН анисовая кислота, п-СН3ОС6Н4СНО анисовый альдегид, 3,4-(СН3)2С6Н3СООН вератровая кислота, ванилин и пиперональ. В соответствующих спиртах АrСН2ОН радикал АrСН2- называют анисилом, вератрилом и т. д. Такие спирты правильно называть анисовый спирт, вератровый спирт. Однако такие заместители, как СН3ОС6Н4, (СН3О)2С6Н3 и т. д., также часто называют анисилом, вератрилом и т. д., что подчас ведет к ошибкам. Поэтому разумнее эти два типа радикалов называть АrСН2-алкоксибензилом и Аг-алкоксифенилом.
Название радикала (C6H5)3C тритил применяют как префикс, но оно не используется в радикало-функциональных названиях. Например, (C6H5)3COH называют трифенилметиловым спиртом, но не тритиловым спиртом.
Применение термина "карбинол" для названия продуктов замещения водорода в метиловом спирте СН3ОН, например, дипропилкарбинол для структуры (С3Н7)2СНОН, полностью запрещено правилами IUPAC (так же как и производное от него название радикала - карбинил). Однако в литературе эти термины иногда все еще встречаются.
Названия алкоголятов и фенолятов образуются добавлением к названию исходного спирта суффикса "-ат" ("-ят") [или суффикса "-олат" ("-олят") к названию соответствующего углеводорода] и названия металла. Например: метанолят натрия CH3ONa, фенолят натрия C6H5ONa. С другой стороны, название этих соединений может быть составлено из названия катиона и радикала с добавлением суффикса "-оксид", например: С6Н11ОNa циклогексилоксид натрия. Для производных некоторых широко распространенных гидроксисоединений (спиртов C1-С4 и фенола С6Н5ОН) рекомендуется использовать привычные сокращенные названия, например: (СН3)3СОК трет-бутоксид калия, (С6Н5О)2Са феноксид кальция.
Простые эфиры
В несложных случаях для простых эфиров вполне применимы радикало-функциональные названия, например: диметиловый эфир, метилнафтил-1-овый эфир, нафтил-1-пропиловый эфир (обратите внимание на алфавитный порядок записи радикалов).
Название префикса для эфирного заместителя RO- образуется добавлением к названию радикала R суффикса "-окси". Например: гептилокси, гептенилокси, однако для радикалов C1-С4 и фенила используется более краткая форма, когда отбрасывается суффикс "-ил" от названия радикала и он заменяется суффиксом "-окси", например: метокси или фенокси. Это относится также и к групповому названию: алкокси.
В применяемой СА заместительной номенклатуре для простой эфирной группы RO нет суффикса, и эта группа должна фигурировать только в префиксе. Даже самые простые эфиры при этом получают довольно необычные названия, например: C2H5OC2H5 1-этоксиэтан. Однако алкокси-префиксные названия становятся удобнее названий с использованием слова эфир, когда один из составляющих радикалов много больше другого или имеется несколько алкоксигрупп. В качестве примера приведем названия 3β-метокси-5α-холестан и 2,3,5-триметоксихинолин.
Названия с использованием слова эфир удобны не только в простых случаях и для симметричных соединений (например: дибутиловый эфир удобнее 1-бутоксибутана), но и для эфиров полиолов или фенолов, имеющих хорошо известные тривиальные названия, например: 1,3-диметиловый эфир глицерина или триметиловый эфир флороглюцина.
Префиксом для -О- служит "окси-", для -ОО- "диокси-" ("перокси-"). Соединения ROOH называют R-гидропероксидами, соединения ROOR - R-пероксидами, где R - названия радикала.
Продукты присоединения к олефиновой связи озона издавна называют озонидами, например: С4Н8О3 бутен-2-озонид.
Кислоты и их производные
Названия органических кислот имеют окончания (суффикс) "-овая кислота" или "-карбоновая кислота". Существуют многие сотни полутривиальных названий кислот: насыщенных, ненасыщенных, ароматических, гетероциклических, гидрокси- и аминокислот, а также некоторых сульфокислот. Некоторые из этих названий возникли еще в 17-ом столетии. Далеко не полный список таких названий приведен в правилах IUPAC, здесь же основное внимание будет сосредоточено на систематической номенклатуре.
Небольшое число соединений, обладающих иными, чем СООН и SO3H, кислотными группировками, издавна также называют кислотами. Некоторые из таких названий, например пикриновая кислота, стифниновая кислота и аскорбиновая кислота, настолько прочно привились, что их не стоит менять, другие же, например крезиловая кислота (иначе - крезол) для названия технических смесей метилфенолов, из научной номенклатуры исключены и не должны более употребляться. С другой стороны, аминокислоты почти всегда фигурируют под тривиальными наименованиями, например: цистеин, орнитин, чем подчеркивается их более важная аминная, нежели кислотная функция. Поскольку названия производных кислот строятся на основе изменения окончаний "-овая кислота" или "-карбоновая кислота", то использование отмеченных тривиальных названий создает определенные затруднения.
Прежде чем заняться более детально кислотами и их производными, стоит остановиться на историческом аспекте, пояснить, как номенклатура этого хорошо известного класса соединений менялась от случая к случаю, пока не превратилась в простой и ясный ряд. Английские названия, оканчивающиеся на "-ic acid" произошли от французского названия acide acetique, в котором acetique является именем прилагательным, превратившимся в английском языке в acetic. Если угодно, слово acetic можно рассматривать как "псевдорадикальное" название, а слово acid (кислота) - как функциональное название класса. Названия солей и сложных эфиров - ацетат натрия и этилацетат - также являются пережитками истории; еще Берцелиусом они были скопированы с издавна известного хлорида натрия и этилхлорида. Названия ацильных радикалов, таких как ацетил, бензоил и циклогексанкарбонил, легко включились в современную практику, что привело к таким названиям, как ацетилхлорид и сходным названиям по радикало-функциональной номенклатуре. Название амида - N-ацетилпиперидин, включает использование слова ацетил в префиксе, в то время как названия ацетамид и ему подобные, могут быть восприняты, как указывающие на получение данного соединения из кислоты и аммиака. Наконец, название нитрил, по-видимому, происходит от "нитр-", но этиология окончания "-ил" не ясна.
Карбоновые кислоты. Все обычные и некоторые необычные кислоты, встречающиеся в жирах и маслах, равно как низшие алифатические и некоторые простые ароматические кислоты имеют полутривиальные названия. Тривиальные названия от муравьиной до валериановой (и изовалериановой) кислот используются в химии повсеместно, но после кислоты С6 рекомендуется применять систематические названия, так как тривиальные названия кислот С6 (капроновая), С8 (каприловая) и С10 (каприновая) так сходны между собой, что легко вызывают путаницу.
Систематические названия карбоновых кислот могут быть образованы двумя путями: (1) добавлением к названию алкана, алкена, алкина и др. окончания "-овая кислота" или (2) обозначением группы СООН окончанием "-карбоновая кислота".
В случае (1) углеродный атом группы СОOН рассматривается как составная часть главной углеродной цепи, а "-овая кислота" означает присутствие группировки OOH, но не COOH. Например, углеводород н-нонан н-С8Н17СН3 таким путем дает нонановую кислоту н-C8H17COOH, в которой С в группе СОOН происходит от СН3-группы н-нонана; этот углеродный атом при нумерации получает локант 1. Для α,ω-дикарбоновых кислот к названию углеводорода добавляют окончание "-диовая кислота"; от н-нонана таким путем производят нонандиовую кислоту НО2С(СН2)7СО2Н. В данном случае применения локантов не требуется.
В случае (2) окончание "-карбоновая кислота" означает замену одного атома Н на группу СОOН, т. е. увеличение числа атомов углерода в молекуле. Так, кислота н-С8Н217СОOН могла бы быть таким путем названа октанкарбоновой-1 кислотой (но так ее называть не следует). В этом примере локант 1 получает атом углерода, следующий за карбоксильной группой.
Для кислот, в которых группа СОOН присоединена к циклической структуре, обязательно применение способа (2) или же использование полутривиального названия, например: пирролкарбоновая-1 кислота или бифенилдикарбоновая-2,2' кислота.
Читатель знаком с большим числом названий кислот, оканчивающихся на "-овая кислота", "-ойная кислота" или "-карбоновая кислота". Эти окончания встречаются во всех тривиальных и полутривиальных названиях алифатических кислот, но не во всех их систематических эквивалентах. Среди названий кислот циклических структур нет строгой последовательности в окончаниях, например: бензойная кислота, толуиловая кислота, нафтойная кислота, фталевая кислота, коричная кислота, фурановая кислота (пирослизевая кислота), никотиновая кислота. В указателях СА сохранены только четыре тривиальных названия кислот: муравьиная, угольная, уксусная и бензойная. Все прочие карбоновые кислоты, за исключением биологически важных аминокислот, получают систематические названия.
Правилами ИЮПАК 2013 года в качестве предпочитаемых оставлены следующие исторические названия: CH3COOH уксусная кислота, C6H5COOH бензойная кислота, H2NCOOH карбаминовая кислота, HOCN циановая кислота, HCOOH муравьиная кислота, HOOC-COOH щавелевая кислота, H2NCOCOOH оксамовая кислота, H2NC(=NH)OH карбамимидовая кислота.
Пероксикислоты. Кислоты, содержащие группу -С(О)ООН, называют пероксикислотами. В индивидуальных названиях префикс "перокси-" помещают либо перед тривиальным названием кислоты, либо перед названием, оканчивающимся на "-овая кислота", а в случае кислот с окончанием "-карбоновая кислота" - перед этим окончанием. Например: СН3СН2СН2СО3Н пероксимасляная кислота, С6Н11СО3Н циклогексанпероксикарбоновая кислота и о-С6Н4(СО3Н)2 дипероксифталевая кислота. Исключениями являются: НСО3Н пермуравьиная кислота, СН3СО3Н перуксусная кислота и С6Н5СО3Н пербензойная кислота. СА для пероксикислот применяет другие названия, заменяя окончание "-овая кислота" на "-пероксовая кислота" и "-карбоновая кислота" на "-карбопероксовая кислота". Например, СН3СО3Н этанпероксовая кислота или С6Н11СО3Н циклогексанкарбопероксовая кислота.
Названия серусодержащих кислот составляются аналогично карбоновым кислотам с использованием для соединений RSO3H окончания "-сульфоновая кислота", для RSO2H окончания "-сульфиновая кислота" и для RSOH окончания "-сульфеновая кислота". Окончание при этом добавляют к названию родоначального соединения, но не радикала из него, например: C6H5SO3H - это бензолсульфоновая кислота, но не фенилсульфоновая кислота. Названия производных серусодержащих кислот составляют так же, как и для карбоновых кислот.
Префиксами для обозначения кислотных групп служат: для -СОOН "карбокси-", для -SO3H "сульфо-", для -SO2H "сульфино-" и для -SOH "сульфено-".
Название ацильной группы RC(O)- зависит от того, какой тип номенклатуры был использован: радикало-функциональная или заместительная номенклатура, а также от того, какие правила используются. Согласно правилам IUPAC, название кислотного радикала производится от названия кислоты заменой окончания "-овая кислота" или "-ойная кислота" на суффикс "-оил" или заменой окончания "-карбоновая кислота" на суффикс "-карбонил". Для тривиальных, но обычно применяемых названий ацильных групп C1-C5 используют суффикс "-ил", а не "-оил", кроме того, "-ил" вводится вместо суффикса "-ин" для обозначения превращения тривиальных названий аминокислот, в название их ацильного радикала. Это приводит к таким названиям ацильных радикалов, как гексаноил, фталоил - о-С6Н4(СО-)2, циклогексанкарбонил, ацетил, аланил, и к полным названиям соединений, таким как гексаноилхлорид, ацетил-катион. Заместительные префиксы правил IUPAC имеют тот же вид, за исключением того случая, когда они образованы из окончания "-карбоновая кислота". Тогда RC(O)- называют в префиксе соединения, где R дает имя радикалу, а СО, как обычно назван "карбонил". Таким образом, составлено, например, название 1-(циклогексилкарбонил) пиперидин.
Радикало-функциональные названия СА почти во всех случаях отличаются от таковых в правилах IUPAC. В указателях СА используются тривиальные названия только трех радикалов: формил, ацетил и бензоил. Ацильные группы от кислот, произведенные от названий кислот с использованием окончания "-карбоновая кислота", называют "циклоалкилкарбонил" и "арилкарбонил" (но не "циклоалканкарбонил" или "аренкарбонил", как это принято правилами IUPAC); например: флуоренилкарбонил. Все другие RC(O)- группы, рассматриваемые как заместители, называют как 1-оксоалкильные группы, например: СН3СН2С(О) - 1-оксопропил (ранее называли пропионил или пропаноил) и -(О)ССН2СН2С(О)- 1,4-диоксобутандиил-1,4 (прежде называли сукцинил или бутандиоил). Такие оксоалкильные названия хорошо описывают структуру, но непривычны и могут заслонить функциональную взаимосвязь ацильного радикала с соответствующей кислотой.
Различия между радикало-функциональными и заместительными названиями кислотных радикалов касаются также и серусодержащих аналогов; в соединениях с заместителями X-SO2-, X-SO- и X-S- для обозначения групп >SO2 используют префикс сульфонил, для >SO - сульфинил и для >S - тио. Например, если C6H5SO2- выступает в роли заместителя, то такую группировку называют в префиксе бензолсульфонил-.
Аналогичные префиксные названия применяются и во многих других случаях. Очень важным является сложноэфирный префикс RO2C-, четко называемый алкоксикарбонилом, например: метоксикарбонил, бензилоксикарбонил; группу СlOС- называют хлорформилом. Поскольку NH2CO2H называется карбаминовой кислотой, то по правилам IUPAC остаток NH2C(O)- называют карбамоилом (по СА: аминокарбонил).
Ионы RCOO- и аналогичные серусодержащие ионы называют заменой "-овая кислота" на суффикс "-ат" или "-оат", в зависимости от того, какое окончание было у кислоты. Примерами здесь могут служить названия: CH3COONa ацетат натрия, С6Н5SО3К бензолсульфонат калия, деканоат калия и бензолтрикарбоксилат-1,2,4 аммония.
Соли аминокислот, имеющих тривиальные наименования, лучше называть так: натриевая соль глицина, но применяется и название типа глицинат натрия, что не выглядит большой ошибкой с точки зрения современной неорганической номенклатуры.
Префиксом для иона -ООС- является карбоксилато.
Сложные эфиры называют по аналогии с солями, хотя уже сто лет известно, что эта аналогия неправильна. Название радикала R в структуре RO-С(О)- заменяет катион в названии соли, например: метилацетат. Следует обратить внимание на то, что в русском языке названия эфиров пишутся слитно, а в английском - раздельно.
Префиксы для сложноэфирных групп были приведены выше. Другой тип префиксов для таких групп, как RC(O)O-, образуется добавлением частицы "окси" к названию соответствующей ацильной группы, например: С6Н5С(О)О- бензоилокси- или С6Н11С(О)О- циклогексилкарбонилокси-.
Для названия соединений RCONH2, RSO2NH2 и др. окончание, характеризующее соответствующую кислоту, заменяется на "-амид", например: ацетамид, гексанамид, пирролкарбоксамид-1 и т. д. Если атом азота замещен, что приводит к структурам R'CONHR2, R'SO2NR2 и т. д., то подобные соединения можно называть как N-замещенные амиды, например: N-метилацетанилид, N.N-диэтилбензамид и т. д. Если группа R при атоме азота сложнее, чем группа R1 в ацильном радикале, то возможно обратное построение названия вещества. Простым примером такого случая служит название 1-ацетилпиперидин. Во многих случаях выбор между обоими названиями произволен.
Когда R фенильная группа, можно использовать названия типа ацетанилид и сульфаниланилид.
Моноамиды простых дикарбоновых кислот можно называть с помощью окончания "-амовая кислота" или "-аниловая кислота", например: о-NН2СОС6Н4СООН фталамовая кислота, С6Н5NНСО(СН2)2СО2Н сукцинаниловая кислота. Однако СА (разумно) применяет более длинные, но и более систематические наименования для этих кислот, а именно 2-(аминокарбонил)бензойная кислота и 3-(фениламинокарбонил)пропановая кислота соответственно.
Подчас возникают или можно представить себе различные более сложные названия ацильных производных аминов. Некоторые из них обсуждаются в правилах IUPAC.
В названиях производных двухосновных кислот обычно подразумевается, что в замещение вовлечены обе кислотные группы. Так, название сукцинат натрия подразумевает динатриевую соль янтарной кислоты, малононитрилом называют CH2(CN)2, а фталамидом - диамид фталевой кислоты. Монометаллическая соль трактуется как кислая соль, например: гидросукцинат натрия. Аналогично называют моноэфиры. Однако для многих таких производных одну группу лучше указывать в префиксе, например: п-ClСОС6Н4СООН п-(хлорформил)бензойная кислота.
По новым правилам кислые соли полиосновных кислот называют аналогично нейтральным солям, обозначая оставшиеся атомы водорода словами "водород", "диводород" и т.д.
Лактоны, лактамы и их серусодержащие аналоги
Для составления названий этих соединений имеется много возможностей, что вызывает большие затруднения. Поэтому здесь будут рассмотрены только способы, широко применяемые на практике и одобренные IUPAC.
Внутримолекулярные сложные эфиры, образующиеся в результате взаимодействия гидроксильной и карбоксильной групп гидроксикислот, сопровождающегося выделением молекулы воды с образованием циклической системы, называют лактонами.
Лактоны, получаемые из моногидроксикислот можно называть заменяя окончание "овая кислота" на "о-локант-лактон". Использование суффикса "-олид", допускаемого ранее, в настоящее время не рекомендуется.
Более сложные, особенно полициклические соединения можно называть как карболактоны; этот суффикс означает включение в циклическую систему группы -СО-О-. При этом локант СО-группы ставится в названии перед локантом О-атома, например пирен-4,3-карболактон.
Если полигидроксикислота имеет тривиальное название, то образующийся из нее лактон может быть назван, исходя из этого названия, как в случае О-глюконо-1,4-лактона.
Соединения, содержащие группы -СО-NH- или -C(OH)=N-, включенные в цикл, предпочтительно называют как гетероциклические соединения, но они могут быть названы и аналогично лактонам, с использованием суффиксов "-лактам" или "-лактим" соответственно.
Сультонами называют внутримолекулярные эфиры, в которых вместо группы >СО находится группа >SO2. Они также могут называться аналогично лактонам с заменой суффикса "-карболактон" на суффикс "-сультон", присоединяемый к названию родоначального соединения. Сультамы являются SO2-аналогами лактамов и обозначаются суффиксом "-сультам" вместо "-лактам". Нежелательно распространять эту систему наименований на другие циклические эфиры и амиды, например циклические сульфиты не следует называть сультинами.
Конечно, все эти соединения могут быть названы обычными для гетероциклов методами.
Нитрилы и их производные
Названия нитрилов алифатического ряда могут образовываться добавлением к названию углеводорода окончания (суффикса) "-нитрил", означающего замену трех концевых атомов водорода на группировку N; при этом число углеродных атомов в молекуле остается неизменным. Этот метод аналогичен названию кислот с помощью окончания "-овая кислота". Примерами могут служить H-C8H17CN нонанонитрил или NC(CH2)7CN нонандинитрил.
Метод наименования кислот с использованием окончания "-карбоновая кислота" может быть трансформирован и для нитрилов с применением суффикса "-карбонитрил", как в названиях пирролкарбонитрил-1, бутантрикарбонитрил-1,2,4.
По третьему методу, когда название кислоты оканчивается на "-ная кислота", при переходе к нитрилу это окончание изменяется на "-онитрил". Примерами служат ацетонитрил и бензонитрил.
Префиксом, обозначающим нитрильную группу, служит "циано-".
Радикало-функциональные названия, в которых нитрильная функция обозначается суффиксом "-цианид", применяют лишь в простых или специальных случаях, например: бензоилцианид C6H5COCN. Согласно правилам IUPAC, если соединение содержит в качестве главной группы одну из групп, содержащих циан, то название составляется по радикало-функциональной номенклатуре, например: С6Н5NСО фенилизоцианат. Если же эти группы не являются главными, то они называются в префиксе, например: NCSCH2COOH- тиоцианатоуксусная кислота. Однако в указателях СА, за исключением -CN, все эти группы приводятся только в префиксах, например: C6H5NCO изоцианатобензол.
Изоцианиды содержат группу -NC. Не следует употреблять названия (и суффиксы) изонитрил или карбиламин.
Альдегиды
Названия альдегидов составляются по одному из следующих методов:
(1) К названию алифатического углеводорода добавляется суффикс "-аль", означающий, что концевой атом углерода содержит группировку - СН(= О) (углеродный атом от исходного углеводорода).
(2) К названию алифатического, циклического углеводорода или гетероцикла для обозначения присоединения -СНО группы добавляется суффикс "-карбальдегид".
(3) Изменением в полутривиальных названиях окончаний "-овая кислота" (или "-ойная кислота") на окончание "-овый (ойный) альдегид".
Методы (1) и (2) аналогичны применяемым для кислот и используются в СА (в СА суффикс "-карбальдегид" недавно заменен на "-карбоксальдегид"), за исключением трех наиболее обычных представителей этого класса, для которых сохранены полутривиальные названия: формальдегид, ацетальдегид и бензальдегид. Другие часто встречающиеся названия составляются по методу (3).
Небольшое число альдегидов имеет специфические тривиальные названия (например: ванилин) или полутривиальные наименования (например: пиперональ).
Оксимы, семикарбазоны, гидразоны и другие сходные производные альдегидов получают названия, составленные из отдельного слова, характеризующего это производное, и названия соответствующего альдегида, например: семикарбазон нонаналя или 2,4-динитрофенилгидразон бензальдегида. Иногда встречаются сокращения, такие как ацетальдоксим или бензальдоксим, но они представляются ненужными и не должны применяться для других альдегидов.
Некоторые соединения, содержащие как альдегидную, так и карбоксильную группу, получают английские названия типа succinaldehydic acid (ср. -амовые кислоты), однако в русской номенклатуре подобные названия не употребляют.
Префиксом группы -СНО является "формил-", который в то же время служит и названием ацильного радикала муравьиной кислоты.
Кетоны
В заместительной номенклатуре кетонов группа =O обозначается суффиксом "-он" или префиксом "оксо-", в зависимости от того, является ли эта группа главной или нет. Примерами могут служить СН3СН2СОСН3 бутанон-2 или 4-оксоциклогексанкарбоновая кислота. СА применяет иную заместительную номенклатуру. Например, такое соединение, как СН3СОС6Н5, там называют: 1-фенилэтанон-1 (l-phenyl-1-ethanon), что необычно, так как незамещенная частица этанон-1 является альдегидом (это ацетальдегид). Применявшийся ранее для обозначения кетонов префикс "кето-" вышел из употребления, но сохранился в групповых наименованиях, таких, например, как кетокислоты.
В радикало-функциональной номенклатуре группа >С=О в кетоне R'COR является функцией; родовым признаком служит окончание "-кетон", которому предшествуют названия радикалов R1 и R, располагаемые в алфавитном порядке. Например, СН3СОСН2СН3 получает таким путем название метилэтилкетон.
Тривиальные и полутривиальные названия кетонов встречаются реже, чем в других классах органических соединений, однако некоторые из них очень существенны: СН3СОСН3 ацетон, С6Н5СОСОС6Н5 бензил, дезоксибензоин, халкон, Н2=С =О кетен (последнее соединение по свойствам резко отличается от обычных кетонов). Частично восстановленный бензил С6Н5СН(ОН)СОС6Н5 называют бензоином. Аналогично называют и его аналоги.
До сих пор все было просто, но дальше начнутся сложности.
Начать с того, что, безусловно, возможен и другой метод составления названий кетонов. RCO- является ацильной группой и может называться как заместитель в соединении R'RCO, и это часто бывает, когда R1 существенно больше или сложнее, чем R (особенно в случае циклических производных). И действительно, например, название 2-ацетилпирен значительно лучше, чем ацетилпиренилкетон. Существует давно бытующий вариант такого составления названий кетонов, в котором для производных бензола и нафталина, в случае небольших ацильных радикалов, суффикс "-ил" заменяют на суффикс "-о", а для обозначения циклической структуры применяются окончания "-фенон" или "-нафтон". В качестве хорошо известных примеров можно привести СбНбСОСН3 ацетофенон, С6Н5СОС6Н5 бензофенон, и 2'-пропионафтон (обратите внимание на штрихи у локантов цикла).
Циклические кетоны заслуживают более детального рассмотрения. Начнем с того, что группа С = О, стоящая рядом с атомом кислорода или азота, характеризует соответственно лактонную или лактамную группировку, и эти соединения могут получать названия, отвечающие этим классам соединений. Однако в действительности многие лактоны и почти все лактамы обычно получают названия, соответствующие обычным кетонам.
Уже говорилось, что символ хH (где х - локант, а H - "обозначенный водород") помещается перед названием циклического соединения, в котором содержится "лишний" водород, остающийся после распределения в молекуле максимально возможного числа сопряженных двойных связей. Такая ситуация возникает, например, в молекулах индена и карбазола. Оба эти соединения столь широко известны, что обозначенный водород обычно в их названиях не указываются.
Иное затруднение возникает, когда оксогруппа вводится в родоначальную циклическую систему, не содержащую лишнего атома водорода. Так, из пирена могут быть получены два кетона и, естественно, что положение в них "обозначенного водорода" должно быть отмечено в названии. Однако поскольку этот водород возник вследствие введения в молекулу оксогруппы, а не обусловлен скелетом самого пирена, "обозначенный водород" должен быть объединен с суффиксом "-он", а не с наименованием пирена. Таким образом для этих кетонов получаются соответственно названия пиренон-2(1H) и пиренон-2(7H).
Прежде чем двигаться дальше, следует сделать небольшое отступление. Согласно правилам IUPAC (но не СА), некоторые названия кетонов могут быть сокращены. Типичными примерами могут служить следующие названия: антрон [для антраценона-9(10H)], а также акридон, пиридон, пиперидон, хинолон и изохинолон, образующиеся в результате пропуска частицы "ин" в середине слова. В некоторых случаях пропускается также указание на "обозначенный водород". Давно установленные структуры для пиразолона-4 и пиразолона-5 соответственно не отвечают рассмотренным выше правилам, так как из каждого цикла могут быть удалены два атома водорода, однако, несмотря на это, указанные названия широко применяются в литературе. Упрощенные названия оксазолон-4, изооксазолон-4 и тиазолон-4 указывают наличие в цикле этих соединений последовательностей СО-СН2-О или СО-СН2-S, и следовательно, они не содержат максимального числа сопряженных двойных связей.
Номенклатура некоторых циклических ди- и поликетонов имеет свои особенности. Издавна ароматические, полностью сопряженные дикетоны и тетракетоны получали названия добавлением к названию родоначального углеводорода или гетероцикла суффикса "-хинон" [родоначальное название иногда сокращается, как в случае антрахинона]. По СА, как обычно, антрахинон получает название антрацендион-9,10 (9,10-anthracenedione).
Более серьезные трудности у авторов могут возникнуть, например, при названии производных пиридина.
Оксимы, гидразоны и другие производные кетонов получают названия аналогично соответствующим производным альдегидов.
Амины
В заместительной номенклатуре для наименования аминов применяется суффикс "-амин", присоединяемый к названию углеводорода или гетероцикла, аналогично суффиксам "-ол" или: "-он". Например: этанамин CH3CH2NH2, пентантриамин-1,3,5 H2NCH2CH2CH(NH2)CH2CH2NH2, пиридинамин-2 2-(H2N)C5H4N.
Эти названия не столь привычны, как названия, созданные на основе гофмановской теории типов много лет назад и рассматривающие амины как продукты замещения водорода в родоначальном соединении на аммиак: этиламин, метилэтиламин, триэтиламин, фениламин (анилин), N-метилбензиламин. Эта система наименований также разрешена правилами IUPAC, однако лучше забыть старое и применять как основу название углеводорода, а не радикала.
В указателях СА ныне применяется исключительно система суффиксов, хотя название анилин все еще не изжито из обычной практики. Для вторичных и третичных аминов в качестве родоначального соединения выбирается наибольший углеводород (если такой выбор возможен), а остальные группы называются в префиксах с применением в качестве локантов курсивных букв N- и N,N-. Например:
CH3NHCH2CH3 N-метилэтанамин, (C2H5)2NC6H5 N,N-диэтилбензоламин (N,N-диэтиланилин), (CH3)3N N,N-диметилметанамин.
В гетероциклах, содержащих NH-группу, цифровой локант заменяет букву N, например: 1-фенилимидазол.
В качестве префикса для группы H2N- в номенклатуре принят слог "амино-", но свободный радикал H2N· называют "аминил-".
Многие амины имеют полутривиальные наименования, это особенно относится к алкалоидам, другим гетероциклическим основаниям и аминокислотам.
Ряд замещенных анилинов издавна называют с помощью суффикса "-идин", например: ксилидин, анизидин и др., но большинство этих специальных названий вышли из употребления, за исключением толуидина, бензидина (название которого трудно произвести от бензола) и, конечно, анилина.
Правила названия органических соединений IUPAC явно не устанавливают общей системы для наименования солей первичных, вторичных и третичных аминов, но правила названия неорганических соединений предписывают называть их как замещенные аммониевые соли, например: [(C2H5)2NH2]+C1-диэтиламонийхлорид. Такие названия недвусмысленны и вполне понятны. Однако представляется, что лучше следовать предписаниям СА, которые образуют названия протонированных ионов первичных, вторичных и третичных аминов добавлением к слову "амин" суффикса "-ий". Это дает для соли (СН3NН3)+С-~ название метанаминийхлорид, для соли (C5H5NH)+NO3- - пиридинийнитрат. Конечно, название метиламинийхлорид также приемлимо. Однако для составления названий солей аминов и двухосновных кислот следует приложить некоторые усилия. Например, соль (C6HsNH3)+HSO4~ называют анилинийгидросульфат, a (C6H5NH3)22+SO42- - дианилинийсульфат; отметим сразу же, что названия анилинсульфат и анилинийсульфат могут относиться к обеим показанным солям.
Иногда все еще применяются такие названия, как гидрохлорид анилина или пикрат пиридина. Обратите внимание на то, что префикс "гидро-" включается только с названием галогенида: гидрохлорид, гидробромид или гидроиодид анилина, но пикрат или нитрат анилина. Вероятно, эта старая нерациональная практика проистекает из названий кислот.
По правилам IUPAC четвертичные соли называют как аммониевые соли, например: (CH3)4N+Br- тетраметиламмонийбромид, однако СА рассматривает теперь соль как производное исходного первичного амина. Таким образом, указанная выше соль получает название N,N,N-триметилметанаминийбромид, а [С6Н5N(СН3)3]+ называют N,N,N -триметилбензоламиний-ионом (N,N,N-trimethylbenzeneaminium ion). Иногда четвертичные соли трактуются по старому методу как "мето"-соли, например: триэтиламинметохлорид, хинолинметопикрат; эти устарелые названия не должны более употребляться, хотя их все еще иногда применяют для единений невыясненной структуры.
ИЮПАК 2013 сохраняет как предпочитаемые следующие исторические названия: C6H5NH2 анилин, H2N-N=CH-N=NH формазан, H2NC(=NH)NH2 гуанидин, H2NCOCONH2 оксамид, H2NCONH2 мочевина.
Соединения серы
Сульфоновые, сульфиновые и сульфеновые кислоты уже рассматривались выше, однако имеется много других типов органических соединений, содержащих серу, для которых: принятая номенклатура IUPAC сложна, часто малопонятна и в общем неудовлетворительна. Рассмотрим следующие факты.
Слог "тио" для обозначения серы встречается в названиях (частях названий): тиол, тион, тиониа и тио как таковой; неоднократно упоминавшиеся слоги "тиа" по системе Ганча-Видмана обозначают присутствие атома серы в цикле или, по заменительной номенклатуре - замену атома углерода на серу.
В заместительной номенклатуре слог "тиол" является суффиксом, если -SH группа присутствует в качестве главной, например: CH3SH в метантиоле. Однако если эта группа не является главной, то для ее обозначения применяют префикс "сульфанил-" (ранее использовался префикс "меркапто-").
Если сера, связанная двойной связью (C = S), является главной группой, то для ее обозначения применяется суффикс "-тион", аналогично тому, как карбонильная группа (С = О) обозначается суффиксом "-он"; например: CH3CH2C(= S)CH3 бутантион-2. Родовым названием данного класса является слово "тиокетоны", а префиксом, если группа C = S не является главной, служит слог "тиоксо-".
Катион (R3S)+ получил название "сульфоний", например: (CH3)3S+Cl- триметилсульфонийхлорид. В префиксе катион R3S+ называют "сульфонио-", в заменительной номенклатуре для него используют префикс "тиониа-".
Термин "тио-" (не видоизмененный) требует более подробного рассмотрения. Он применяется в двух различных случаях: для обозначения -S- как линейного компонента и для замены атома кислорода (в последнем случае это приводит к "тиокетонам" и "тиоксо-").
Связывание двухвалентной серы -S- (называемой "тио") с органической группой приводит к радикалу RS-, называемому "R-тио", например: CH3S- метилтио-, точно так же, как: двухвалентный радикал >СО карбонил- приводит к радикалу метоксикарбонил- для СН3ОС(О)-. Названия типа "метилтио-" помещаются в префиксе, если серусодержащая группа присоединена к большой группе, как в случае 1-(метилтио)пирена. Конечно, для указанных названий имеется радикало-функциональная альтернатива, например использование слова "сульфид" как функционального названия класса (вспомните неорганическую химию, которая приводит к этой старой номенклатуре).
Суффиксу "-сульфид" в названии R'SR'' предшествуют названия радикалов, помещаемые в алфавитном порядке, например: CH3SCH2CH3 метилэтилсульфид, C2H5SC2H5 диэтилсульфид. Для простых соединений такие названия широко применяются.
Соли тиолов называются тиолатами, например: CH3CH2SNa этантиолат натрия или, по правилам радикало-функциональной номенклатуры, этилсульфид натрия.
Казалось бы очевидным, что если группу AlkS - называют - "алкилтио-", то группу HS- следует называть "гидротио-", но это отвергнуто, вместо этого используется "меркапто-", происходящее от старого названия класса соединений RSH (меркаптаны); теперь это название заменено названием тиолы.
Другой вариант использования слога "тио" для звена -S- заключается в наименовании симметрично построенных соединений, таких как S(CH2CH2COOH)2, которое проще назвать как 3,3'-тиодипропионовая кислота.
Совершенно иным, и иногда неудачным, является использование слога "тио" для обозначения замены атома кислорода серой, что имеет целью подчеркнуть аналогию между этими двумя классами соединений. Наибольшие трудности возникают, когда слог "тио" применяют для обозначения замены кислорода, связанного простыми связями с двумя группами или атомами. Например, С6Н5SН тиофенол, звучит совершенно одинаково с названием гидроксипроизводного тиофена. Другой пример: соединение 4H-пиран; таким образом, при замене кислорода на серу соединение получает название 4H-тиопиран, однако под названием тетрагидротиопиранон-4 можно подразумевать 2 разных соединения. В то время как одно логичнее назвать тетрагидропирантион-4, второе лучше назвать по системе Ганча-Видмана тетрагидротиапиранон-4. Можно отметить, что не исключены и другие решения.
Особый случай представляет соединение HSCH2COOH, которое иногда называют тиогликолевой кислотой, так как она является аналогом гликолевой кислоты НОСН2СООН. Сложность состоит в том, что термин "тиогликолевая кислота" принадлежит также к аналогу гликолевой кислоты, в котором на серу заменен один из атомов кислорода карбоксильной группы. Разрешить эту сложность можно, лишь применяя для кислоты HSCH2COOH название меркаптоуксусная кислота. Имеются и другие примеры для обоих рассмотренных выше осложнений.
Приставки "тио" и "дитио" также широко применяются в названиях тиокислот как неорганических, так и органических, таких как тиоуксусная кислота CH3C(O,S)H (заключение в скобки в данной формуле означает, что атом водорода может быть связан либо с атомом серы, либо с атомом кислорода) или дитиобензойная кислота C6H5CS2H, в которых один или оба атома кислорода карбоксильной группы заменены на серу. Термин "дитио" однозначен, в то время как термин "монотио" неспецифичен, так как он не дает информации о том, замещен ли на серу кислород карбонильной группы или гидроксильной; уточнение этой неопределенности необходимо, так как место присоединения (локализация) атома водорода весьма существенно (хотя предположительно, он скорее находится у S, нежели у О). Если этот вопрос точно решен, то соответствующие соединения должны быть названы, скажем, так: CH3C(= O)SH тиоуксусная S-кислота и CH3C(= S)OH тиоуксусная О-кислота. Обычно такое различие можно провести для соответствующих сложных эфиров, и тогда их легко различать по названиям, например: S-метилтиоацетат для CH3C(= O)SMe и О-метилтиоацетет для CH3C(= S)OMe.
Для кислот, название которых оканчивается на "-карбоновая кислота", суффиксы серусодержащих аналогов выглядят так: "-карботионовая кислота" и "-карбодитионовая кислота". Старые суффиксы, служившие для различения этих кислот: "-тиоловая кислота", "-тионовая кислота" и "-тионотиоловая кислота", отвергнуты правилами IUPAC.
Наименования R-сульфонил- для радикала RSO2- и R-сульфинил- для RSO- (где R - название органического радикала) описаны выше. Их надо отличать от терминов "сульфон" и "сульфоксид", означающих родовые названия соответствующих классов в радикало-функциональной номенклатуре, например: CH3CH2S(O)CH3 метилэтилсульфон.
В качестве префиксов для групп RS2-, RS3- и т. д. применяют термины "R-дитио-", "R-тритио-" и т. д. (где R - название органического радикала); в радикало-функциональной номенклатуре их заменяют термины дисульфид, трисульфид и т. д., например: CH3S2CH2CH3 метилэтилдисульфид. Недавно разработана новая номенклатура для уже известных или еще не полученных соединений, содержащих цепь, состоящую из атомов серы; эта номенклатура основана на названии сульфан для родоначального соединения HSH. Таким образом, соединение HSSH получает название дисульфан, HSSSH - трисульфан и т. д. Группы или атомы, замещающие в сульфанах атом водорода, указывают в префиксе. Так, C6H5SSH будет называться фенилдисульфаном, CH3CH2SSSC1 - хлорэтилтрисульфаном. Даже если заместитель обладает кислотными свойствами, он все равно указывается в префиксе, например: CH3SSSOH называют 1-гидрокси-3-метилтрисульфаном; натриевую соль CH3SSSNa называют метилтрисульфанидом натрия, а натриевую соль CH3SSSONa - 3-метил-1-оксидотрисульфанидом натрия ("оксидо" означает О-).
"Обозначенный водород"
Понятие "обозначенный водород" (изображаемый курсивом H с цифровым локантом перед ним) обсуждалось выше. В первом случае "обозначенный водород" фигурировал в таких названиях, как 1H-флуорен и 4H-пирен, где после введения в цикл максимально возможного числа некумулированных двойных связей оставался "лишний" атом водорода, причем возможна его различная локализация. Таким образом, местоположение этого водорода следует "показывать" локантом. Второй раз речь шла о кетонах. В данном случае кетоны формально рассматривались как полученные из циклической системы, содержащей "обозначенный водород" путем замены группы СН2 на СО. При этом оксогруппу обычно называют введением суффикса "-он", например: 1H-флуоренон-1. Однако встречаются случаи, когда "обозначенный водород" возникает лишь после введения в циклическую систему кетонного кислорода. Такой случай может быть иллюстрирован переходом от нафталина к нафталинону-2(1H), где символ 2(1H) показывает, что 1Н появился в результате возникновения 2-оксогруппы.
Вероятно, наибольшая трудность возникает в силу того, что процедура типа 2(1H) применяется только в тех случаях, когда присутствует главная группа, т. е. когда эта группа указывается в суффиксе.
В заключение можно отметить, что "обозначенный водород" имеет преимущество в получении наименьшего локанта после фиксации нумерации в цикле; даже большее, чем радикальная валентность или главная группа.
Стереоизомерия
Стереохимия является разделом химии, посвященным изучению расположения в пространстве атомов, составляющих молекулу, а также их особенностей, ведущих к появлению стереоизомеров. В этой области выдвигалось множество различных номенклатурных предложений, незначительное упрощение было достигнуто лишь недавно благодаря появлению методов установления абсолютной конфигурации и публикации правила последовательности, что позволяет давать названия стереоизомерам в большинстве ситуаций, встречающихся в органической химии. Способы подхода к решению многих простых пространственных соотношений зафиксированы в правилах IUPAC, они оказались вполне приемлемыми. Однако недавняя публикация методов, использованных в сводном предметном указателе СА, внесла новые изменения.
Вначале, однако, необходимо дать определения небольшому числу слов-терминов, которые, хотя и не включаются непосредственно в названия соединений, тем не менее являются частью необходимого словарного состава. Имеются различные толкования их, но мы следуем требованиям IUPAC.
Термин "структура" широко используется в правилах IUPAC для определения различных понятий, например: атомная структура, электронная структура, структура бензола и др. Термин строение ("конституция") используют в правилах IUPAC для обозначения природы атомов в молекуле и последовательности их соединения.
В русской химической литературе термин "конституция" широко употреблялся в прежние времена (в частности, в работах Бутлерова) именно в том смысле, который придают ему правила IUPAC, однако ныне на русском языке он практически вышел из употребления. Вместо этого мы обычно говорим "структура", "строение" (химическое строение по Бутлерову), считая все эти термины синонимами. При необходимости подчеркнуть различие между структурой в общем смысле и конституцией нам придется либо возродить этот старый термин, либо отвыкнуть от отождествления структуры и химического строения.
"Изомерами" называют соединения, имеющие одинаковый элементный состав, но различающиеся либо характером последовательности связывания атомов, либо их расположением в пространстве. Изомеры, отличающиеся характером последовательности связывания атомов, называются структурными изомерами (например, CH3CH2CH2CH3 и (CH3)2CHCH3); изомеры, различающиеся лишь расположением атомов в пространстве, называются стереоизомерами. Прилагательное "стереогенный" применяется для обозначения атомов или групп в молекуле, которые обеспечивают получение неидентичных соединений при перемене пространственного расположения связанных с ними двух атомов или групп. "Стереородоначальная структура" - это структура, полностью или частично тривиальное название которой передает расположение всех или части стереогенных атомов.
Стереоизомеры, которые не могут быть превращены в свои зеркальные изображения только вращением вокруг связей или путем смещения, являются оптически активными. Пары таких стереоизомеров называют "энантиомерами".
Теперь это свойство взаимонепревращаемости называется "хиральностью" (от греческого слова рука). Соответствующим прилагательным является слово "хиральный", поэтому говорят: хиральные молекулы, хиральные группы. В принципе хиральность зависит от отсутствия у молекулы или у группы элементов симметрии, за исключением оси вращения второго порядка (С2). Для последующего использования здесь нужно также отметить, что со структурной точки зрения, хиральное соединение может обладать одним (ой) или более центрами хиральности и/или осей хиральности и/или плоскостей хиральности.
Стереоизомеры, не являющиеся энантиомерами, называют "диастереомерами", они могут быть хиральными или ахиральными. В формулах, как и вообще, жирная линия или клин означают связь, выступающую над плоскостью бумаги, т. е. направленную в сторону наблюдателя, пунктирная линия или клин - означают связь, уходящую за плоскость бумаги, т. е. удаляющуюся от наблюдателя. Обычная сплошная линия означает связь, лежащую в плоскости бумаги.
Если направление связи неизвестно или точно не определено, то вна обозначается волнистой линией.
В проекционных формулах Фишера применяют специальные условности и ограничения. Хиральный атом углерода, лежащий в центре на плоскости бумаги, связан направо и налево с атомами или группами, которые рассматриваются как направленные к наблюдателю, а атомы и группы, связи к которым идут от хирального атома вверх и вниз, рассматриваются как идущие за плоскость бумаги. Главная цепь, если она имеется, располагается вертикально; атом, имеющий наименьший локант, помещается наверху.
Стереоизомеры, взаимопревращаемые вращением атомов или групп вокруг одинарной связи (а по мнению некоторых авторов, также вращением и вокруг двойных связей), называют "конформационными изомерами", иногда "ротамерами" или "конформерами". Стереоизомеры, требующие для взаимопревращения разрыва связи, называют "конфигурационными изомерами". Эти понятия в известном смысле и намеренно неопределенны, поскольку четкое различие между ними провести очень трудно.
Первое правило IUPAC состоит в том, что для обозначения пространственного строения к основному названию соединения, или иногда к замещающим группам, добавляют один или несколько специальных префиксов. Такое обозначение не должно изменять основного названия соединения или его нумерации. Имеется ряд исключений, когда тривиальное название стереородоначального соединения приписано только одному стереоизомеру (например: фумаровая кислота) или когда часть или все полностью пространственное строение характеризуется тривиальным названием, например: 5β-холестан или боромицин. Последний содержит 18 хиральных элементов; для него подсчитана возможность существования 262144 стереоизомеров (!). Эти принципы приняты также и в СА, за исключением того, что в инвертируемых указателях стерические символы помещаются в конце записи.
Основой процедуры правила последовательности является само правило последовательности, при помощи которого лиганды могут быть расположены в порядке старшинства. Установленный таким образом порядок старшинства может применяться для обозначения хиральности самых различных типов.
Начнем с простых примеров, в которых центр хиральности представляет собой атом, соединенный с четырьмя различными лигандами а, b, с, d, расположенными в вершинах тетраэдра. Условимся, что лиганды в соответствии с правилом последовательности располагаются в порядке падающего старшинства так: а>b>с>d, где знак ">" -указывает преимущественность. Ясно, что эта модель изображает асимметрический атом углерода, часто встречающийся в органической химии (или какую-либо другую тетраэдрическую структуру). Она может быть превращена в свой энантиомер при отражении в зеркале. В этом случае процедура правила последовательности заключается в рассмотрении модели со стороны, противоположной младшему лиганду. При этом падение старшинства лигандов а-b-с будет идти либо вправо, по часовой стрелке, либо влево, против часовой стрелки. Правостороннюю форму обозначают как R-форма (R - от латинского слова rectus - правый), левостороннюю форму - как S-форма (S - от латинского слова sinister- левый).
Символы правила последовательности R и S заключают в скобки и помещают перед названием соединения, как например у (R)-1-бром-1-хлорэтана. Если должно быть обозначено, несколько хиральных центров в молекуле, то символам R и S непосредственно предшествуют соответствующие локанты (неотделенные дефисом или промежутком), вместе с которыми R,S-символы заключаются в скобки и помещаются перед названием соединения, как как например у (1R,3S)-1-бромо-3-хлороциклогексана (однако можно использовать и более простую форму: 1R-бромо-3S-хлороциклогексан.
Теперь представим себе, что тетраэдр вытянут в одном направлении. Эта модель имеет ось хиральности, ось второго порядка. В этом случае не требуется, чтобы для возникновения хиральности все четыре лиганда были различными. Хотя они могут быть все различными, но достаточно, чтобы лиганды на одном конце молекулы были разными (а, b) и чтобы вторая пара лигандов (а', b') на другом конце молекулы также отличалась друг от друга. В этом случае процедура правила последовательности состоит в рассмотрении модели с одного из концов. При этом следует считать, что два лиганда на ближнем конце являются более старшими, нежели два лиганда на другом конце. Предположим, что мы смотрим на модель сверху, тогда имеем ряд старшинства a>b>a'>b', и следовательно, здесь снова для различения можно применить символы R или aR. Поскольку этот вытянутый тетраэдр имеет свойства винта, то оказывается несущественным, с какого конца молекулы на него смотреть. Структуры замещенных бифенилов или алленов являются типичными примерами: веществ, обладающих осью хиральности.
Наконец, рассмотрим соединения, обладающие плоскостью хиральности, в частности такие, как (R)-2,5-(октаметилендиокси)бензойная кислота. В данном случае процедура состоит в выявлении группы атомов, обозначенных как а, b, с со стороны ближайшей группы СН2 полиметиленовой цепи. В этом случае также применяется символ R (или для отличия pR).
Следует отметить также, что когда известна только относительная конфигурация, то символы R и S помечаются звездочками (R*, S*). Альтернативно, может быть использован префикс "rel" (относительная). Рацематы (смесь равных количеств энантиомеров) могут быть обозначены: (1) префиксами "рац-" или (±), и если необходимо, кроме того, отмеченными звездочками R,S-символами; (2) для одного хирального центра символом (RS), а для нескольких - символами (RS) и (SR) с соответствующими локантами. Центр, имеющий наименьший локант, всегда получает символ (RS). Если конфигурация частично или полностью описана тривиальным названием, то к нему может быть добавлен префикс "ent" как характеристика энантиомера.
Порядок старшинства. Правило последовательности, которое предусматривает использование ряда старшинства лигандов, требует серии вспомогательных правил для определения этого старшинства.
Вспомогательное правило 1 говорит о том, что больший атомный номер старше меньшего. Это относится к каждому лиганду, рассматриваемому атом за атомом в порядке их связи до тех пор, пока все лиганды не расположатся по порядку. Не возникает никаких трудностей при рассмотрении формулы (R)-1-бромо-1-хлороэтана, где последовательность (старшинство) выражается рядом: Вr>Сl>С>Н. В случае соединения (R)-1-бромо-1-хлоропропан мы сразу видим последовательность Сl>С,С>Н. Однако к центральному атому присоединены два атома углерода, и для того, чтобы сделать выбор между ними, следует учесть, что Вr>Н, и тогда порядок старшинства можно записать так: С(Вr,Н,Н)>С(Н,Н,Н), и общий порядок старшинства лигандов для соединения: Сl>СН2Вr>СН3>Н.
Если два атома связаны кратной связью, то оба они рассматриваются как бы дублированными.
Интересно также, что неподеленная пара электронов рассматривается как лиганд, имеющий атомный номер 0. Например, по правилу последовательности сульфоксиды изображаются, как для метилэтил-R-сульфоксида (IUPAC).
Второе вспомогательное правило состоит в том, что большее массовое число старше меньшего. Это дает возможность принимать во внимание изотопную метку, но только в том случае, когда требования первого вспомогательного правила использованы до конца, но они не дали определенного ответа.
Третье вспомогательное правило касается ситуаций, связанных с классической цис/транс-изомерией, которая рассматривается в следующем разделе. Здесь можно лишь указать, что изомерию двойной связи это третье вспомогательное правило формулирует как порядок старшинства Z>Е в тех случаях, когда это необходимо для принятия решения по правилу последовательности.
Четвертое и пятое вспомогательные правила касаются вопроса о старшинстве между хиральным и прохиральным центрами, однако их точные формулировки до сих пор еще являются предметом обсуждений.
Цис/транс-изомерия
Иные проблемы возникают, если молекула является плоской или может быть условно рассмотрена как частично или полностью плоская. Простейшие случаи - присутствие одной или нескольких двойных связей. При этом задача всегда сводится к указанию, как расположены две или четыре группы на концах двойной связи, чтобы использовать хорошо известные префиксы цис- и транс. Часто это очевидно, как в случае малеиновой или фумаровой кислот. Однако для СА в 1968 г. возник ряд довольно больших трудностей, и для этих целей потребовалось применить правило последовательности. Для замены старых префиксов цис- и транс- были выбраны новые префиксы: Z и Е (от немецких слов zusammen - вместе и entgegen - напротив) соответственно (следует иметь ввиду, что они не эквивалентны цис- и транс-формам).
Если в моноциклической системе, которую можно представить себе плоской, имеются два центра хиральности [например, 1-хлоро-3-бромоциклогексан] то можно применять либо цис/транс-префиксы, либо правило последовательности. Однако если число хиральных центров возрастает, то применение R,S-символов становится необычайно громоздким. В случае, когда в цикле замещено более двух положений, правила IUPAC предписывают применение цис/транс-префиксов, сокращаемых до c/t. При этом для обозначения заместителя, имеющего наименьший локант, применяют префикс "r" (от слова reference), по отношению к нему остальные группы характеризуются префиксами с, t. СА не применяет эти сокращения, а префиксы цис/транс использует с определенными ограничениями в тех случаях, когда применение символов E/Z не очень удобно.
Когда в цикле содержится много сходных заместителей, все существующие способы индикации существенно усложняются, хотя эти соединения часто встречаются в природе. Поэтому для них была разработана специальная номенклатура (см. далее).
Применение терминов экзо-, эндо-, син- и анти-, не включенных в правила IUPAC, было систематизировано правилами СА; их применение ограничено бицикло[Х.У.Z]алканами, где X больше или равно Y, а он больше Z. Индексы син/анти- описывают расположение заместителей у мостика Z по отношению к группам X. Син- означает направление к группе Z, а анти- - противоположное направление заместителя. Индексы экзо/эндо- показывают расположение заместителей относительно выбранной условной плоскости молекулы, включающей группы X и Y. Экзо- означает направление заместителя со стороны плоскости где находится мостик Z, а эндо- - противоположную. Эти префиксы описывают только относительную конфигурацию.
Если структурная формула би- или полициклического соединения написана в плоской форме в предписанной ориентации на плоскости бумаги, то связи, направленные под плоскость бумаги, изображаются пунктиром и обозначаются греческой буквой α, а связи, поднимающиеся над плоскостью бумаги, изображаются сплошной линией и обозначаются греческой буквой β. α/β-Символы записываются непосредственно после цифровых локантов соответствующих заместителей (без отбивки от локанта или дефиса). Классическим примером могут служить стероиды, номенклатура которых коротко будет обсуждена ниже. Правилами IUPAC применение α/β-символов частично обобщено; в недавно принятой номенклатуре СА, описываемой ниже, оно значительно расширено.
Конформации
Хотя различные доказательства раздельного существования конформационных изомеров и получены, тем не менее, как правило, они не поддаются выделению в индивидуальном состоянии. Поэтому потребность в префиксах для различения индивидуальных конформеров невелика и лишь немногие способы узаконены для указания того, каким образом те или иные группы присоединены к шестичленным кольцам. Группа, присоединенная к кольцу связью, образующей с плоскостью, в которой лежит большая часть атомов кольца, незначительный угол, получает индекс (е) - экваториальная, этот индекс помещают за локантом группы. Группа же, присоединенная к кольцу связью, образующей большой угол с плоскостью кольца, получает индекс (а) - аксиальная. Если в мононенасыщенном шестичленном кольце группа присоединена к атомам углерода, соседствующим с двойной связью, то для нее применяют термины "псевдоэкваториальная" (е') или "псевдоаксиальная" (а').
К другим конформационным терминам, одобренным правилами IUPAC, но не включаемым непосредственно в названия соединений, относятся термины "кресло", "ванна" и "полукресло", которые описывают форму шестичленного кольца, а также обозначения двугранного угла в системе связей А-С- -С-В, характеризуемые терминами "заслоненная конформация", "заторможенная конформация" и др. В специальных областях, таких как углеводы, полимеры, белки и нуклеиновые кислоты, имеется и ряд других более или менее известных специальных обозначений.
Взаимопревращения конформаций зависят от вращения вокруг одной или нескольких связей, что может быть иллюстрировано на примере вращения вокруг С-С связи в замещенном этане, как это может быть показано на перспективных проекциях ("лесопильных козлах"). Для обозначения таких структур может быть применено правило последовательности для каждой триады лигандов а, b, с. В триадах с тремя разными лигандами (а, b, с) а и а' считаются старшими, в случае триады a, b, c два одинаковых отбрасываются (а считается старшим). Соответствующие проекции Ньюмена показывают, что вращение а', требуемое для наложения на а, может осуществляться вращением вправо в Р-форме (Р от plus - "плюс") или вращением влево в M-форме (М от minus - "минус"). Среди причин, обусловивших выбор этих обозначений, были и соображения о том, что использование символики (+) и (-) может ассоциироваться с необходимым направлением вращения.
Современная практика стереоизомерии в указателях Chemical Abstracts
В 1975 г. для девятого сводного указателя СА (период 1972-1976 гг.) были опубликованы пересмотренные правила обозначения стереоизомеров. Они включают 16 правил и 30 примеров, направленных на то, чтобы стереоизомеры, и особенно энантиомеры, оказались включенными в общую, последовательную систему сводных указателей и для того, чтобы установить определенный порядок применения каждого стереосимвола. Эти правила включают большинство обычных ситуаций, однако здесь могут быть освещены лишь наиболее существенные аспекты.
В указателях СА стереохимические символы помещаются: после нестереохимического названия или после стереородоначального названия, но они сопровождаются дефисами, указывающими, что эти символы, написанные курсивом, должны в неинвертированной форме названия предшествовать остальной части английского названия соединения, как это обычно и принято.
Для следующих случаев новые правила сохраняют описанную выше прежнюю практику:
(1) старшинство лигандов, устанавливаемое правилом последовательности;
(2) применение символов R/S для указания хиральности, если в молекуле имеется только один тетраэдрический центр с известной абсолютной хиральностью;
(3) символы E/Z для обозначения геометрической изомерии у двойной связи.
Однако для большинства случаев применена новая процедура: относительная конфигурация обозначается одним или несколькими символами R*/S*, α/β, цис/транс или эндо/экзо, которые применяются, будучи заключенными в скобки, как это описано в данной главе ранее. Абсолютная конфигурация, если она известна, обозначается символами R или S для центра, имеющего наименьший локант, или (иногда) для центра, выбранного на основании правила последовательности. Если необходимо, этому символу может предшествовать его локант. Символы абсолютной конфигурации должны предшествовать символам относительной конфигурации и отделяться от них дефисами, а все вместе должны помещаться в квадратные скобки, например: 1R-(1α,3α,5β)-.
Если в цепи имеется только два центра хиральности, для которых известна лишь относительная конфигурация, то она изображается как R*,R* для центров с одинаковой хиральностью, либо как R*,S* для центров с противоположной хиральностью. Затем, если абсолютная хиральность известна, это указывается с помощью символов R или S, определенных, если это необходимо, для хирального центра, предпочтительного по правилу последовательности.
Если в цепи содержится более двух хиральных центров, то могут быть применены сходные приемы, однако символы должны следовать за локантами и вместе с ними заключаться в скобки. Относительная хиральность центра с наименьшим локантом помечается символом R*, и по отношению к нему выбираются обозначения остальных. Если абсолютная хиральность известна, тогда центр, имеющий наименьший локант, помечается символом R или S в соответствии с его действительной хиральностью.
Углеводы
Для сопоставления названий с формулами простых углеводов (моносахаридов) легче всего пользоваться проекционными формулами Фишера, в которых карбонильный атом углерода находится наверху (или в верхней части), хотя достаточно наглядны также и формулы Хеворта. По правилам IUPAC/IUB для моносахаридов от С3 до С6 (по правилам СА - для С5 и С6) разрешено применять тривиальные (стереородоначальные) названия (например: арабиноза, рибоза, галактоза, глюкоза, манноза, фруктоза), однако для них и для многих других могут быть составлены и систематические наименования. Последние составляются из:
(1) одного или нескольких префиксов, описывающих конфигурацию;
(2) цифрового слога (или слогов), определяющих число атомов углерода в цепи и
(3) суффиксов "-оза" (для альдоз) и "-улоза" (для кетоз).
Каждый префикс соединения состоит из написанного курсивом наименования альдозы без окончания "-за" (эритро-, рибо-, глюко-, манно- и т. д.), который описывает относительную конфигурацию четырех или меньшего числа хиральных атомов углерода в цепи. Ему предшествует буква D или L, характеризующая абсолютную конфигурацию хирального атома углерода, обозначенного наибольшим локантом. Таким образом получают названия, такие как D-арабиногексулоза-2 (для D-фруктозы) и О-глицеро-О-глюкогептоза. (обратите внимание на то, что иногда бывают необходимы два конфигурационных префикса). Затем для хирального атома углерода, обозначенного наибольшим локантом, префиксом D или L уточняется абсолютная конфигурация, а для глюкозидного атома углерода (то есть связанного с двумя атомами кислорода) конфигурация выражается префиксами α или β, как в обычной α -D-глюкозе. Специальные обозначения применяются для диальдоз ("-одиальдоза"), альдокетоз ("-озулоза") и дикетоз ("-одиулоза"). Ациклические формы сахаров обозначают префиксами "альдегидо-" или "кето-", а размер цикла в циклических формах - суффиксами "-фураноза" или "-пираноза".
Замещение водорода в гидроксильной группе или замещение карбонильного кислорода обозначается как обычно в органической номенклатуре, например: 3-О-метил-О-глюкоза или 3-О-метиловый эфир D-глюкозы; 2,4-ди-О-ацетилальдегидо-О-манноза или 2,4-диацетат альдегидо-О-маннозы; 1,2-О-изопропилиден-α-D-глюкофураноза. Алкил- или арилзамещение по гликозидной гидроксильной группе приводит к образованию гликозидов: этим смешанным ацеталям присваивается наименование "алкил- (или арил) -озид", как в случае метпл-β-О-глюкозида. Аналогично, 1-С-углеводные радикалы называют гликозил-радикалами, например: α-D-маннозил. Соответствующие 1-О-радикалы называются гликозилокси. Эти названия соответствуют различию между R-(алкил) и RО-(алкокси) -радикалами. Замена гидроксильной группы (за исключением таковой ири С-1) на водород описывается цифровым локантом и префиксом "дезокси-". Если в дальнейшем этот атом водорода, в свою очередь, замещается на другую группу, добавляется соответствующий префикс заместителя и повторяется тот же цифровой локант.
Префикс "ангидро-" применяется для обозначения отщепления воды от двух гидроксильных групп, например 2,3-ангидро-4-О-метил-α-D-маннопираноза.
Соответствующие альдозам гидрированные спирты называют заменой в названии альдозы окончания "-оза" на окончание "-ит", например: D-маннит (в английской номенклатуре для этого класса соединений используют окончание "-itol", например: D-mannitol). При окислении сахарида НОСН2... СНО до кислоты НОСН2...СО2Н окончание "-оза" заменяется на "-оновая кислота", а если НОСН2...СНО превращается в НОOС…СНО, то на "-уроновая кислота"; если НОСН2...СНО превращается в НОOС...СОOН,- то на "-аровая кислота". Например: D-глюконовая кислота, L-глюкаровая кислота и метил-α-D-маннопиранозидуроновая кислота.
Обычные дисахариды называют их старыми тривиальными названиями: сахароза, мальтоза, лактоза и др. Однако легко можно построить и их систематические названия (что и используется в указателях СА), такие как гликозилгликозиды (не сокращенно) или гликозилгликозы (сокращенно). Например, для сахарозы получаем название: β-D-фруктофуранозил-α-О-глюкопиранозид. В трисахаридах положения участвующих в связи двух гликозильных групп обозначают двумя локантами; одна или две стрелки показывают последовательность соединения, как, например: ...озил(1→4)... (1→4)... оза.
Старейшей из особых систем обозначения стереохимии является применение заглавных латинских букв D и L в химии углеводов, в зависимости от того, как в классической проекционной формуле Фишера ориентирован заместитель при максимально нумерованном асимметрическом атоме углерода - вправо или влево.
Поскольку формулы Фишера углеводов можут быть сведены к глицериновому альдегиду, абсолютная конфигурация которого точно установлена, то это определяет и точную абсолютную конфигурацию данного соединения. Этот метод обозначения конфигурации общепринят для всей области химии углеводов и их производных.
Полная номенклатура моносахаридов иллюстрируется на примере β-D-глюкопиранозы. Слово "-пираноза" обозначает шестичленный цикл (пиран), слог "оза" обозначает сахар: "глюко-" характеризует относительную конфигурацию при С-2, С-3, С-4 и С-5; β - указывает на конфигурацию при аномерном атоме С-1; D - однозначно говорит об энантиомерной форме всей молекулы.
Символы R/S применяются для обозначения хиральных элементов, не включенных в основную углеводную структуру, например для обозначения конфигурации О,О'-алкилиденовых групп RCH<, присоединенных к стерически не эквивалентным атомам кислорода.
Стероиды
Стероиды являются производными циклопентано[а]фенантрена.
Для удобства отдельные кольца обозначают латинскими буквами от А до D. Правила IUPAC/UIB разрешают для обозначения специфической ориентации заместителя при С-20 использовать префиксы α и β, но предпочтительнее в данном случае пользоваться системой R/S, как и для положений с большим номером. Как правилами IUPAC/ UIB, так и СА, для стереородоначальных соединений используются следующие полусистематические названия:
Гонан: отсутствие боковых цепей при С-17, С-18 и С-19
Эстран: имеется метальная группа С-18, но других заместителей нет
Андростан: имеются метильные группы С-18 и С-19, нет боковой цепи при С-17
Прегнан: В 20 положении H
Холан: В 20 положении CH2CH2CH3 (17β, 20R)
Холестан: В 20 положении CH2CH2CH2CH(CH3b (17β, 20R)
Эргостан: В 20 положении CH2CH2CH(CH3)CH(CH3)2 (17β, 20R, 24S)
Стигмастан: В 20 положении CH2CH2CH(C2H5)CH(CH3)2 (17β, 20R, 24S)
Эти названия отражают (включают в себя) стереохимическую специфику соединений, однако конфигурация при С-5 обозначается дополнительно (5α или 5β), если она известна.
Ненасыщенность и замещения описываются обычным образом, как это принято в номенклатуре органических соединений.
В названиях стероидов часто встречаются специальные структурные префиксы, которые могут быть распространены и на другие природные соединения.
"Цикло-" означает образование дополнительного кольца, непосредственно связанного с атомами углерода родоначальной структуры.
"Нор-" свидетельствует об удалении ациклического атома углерода или о сокращении числа членов в одном из колец родоначальной системы.
"Гомо-" является противоположностью префикса "нор-" и означает расширение какого-либо цикла родоначальной системы; естественно, должно быть указано, какого именно. Префиксы "гомо-" и "нор-" могут быть использованы одновременно в наименовании одного и того же соединения.
"Секо-" (от латинского secure - разрезанный) указывает на разрыв одной связи кольца, с добавлением по одному атому водорода в обоих концах обрыва.
Реже применяются префиксы "фридо-", указывающий на смещение ангулярной метильной группы, и "А-нео-", свидетельствующий о сужении кольца А и других изменениях; малознакомый префикс "абео-" (от латинского - уходить) также означает миграцию связи. Правила IUPAC/UIB рекомендуют предпочтительное использование префикса "абео-" перед префиксами "фридо" и "А-нео-".
Стероиды представляют собой следующую обширную область химии природных соединений, для которой весьма существенна специальная номенклатура. Принципы этой номенклатуры, по-видимому, применимы и к некоторым другим разделам органической химии.
Циклопентанофенантреновый скелет, который является обычным почти для всех стероидных соединений, рассматривают как плоский и ориентируют как 5β-андростандиол-3β,16β.
Группы и атомы, присоединенные к этой полициклической системе, помечаются греческими буквами α или β в зависимости от того, ориентированы ли они под плоскость листа (α) или над плоскостью листа (β). В данном случае это α /β-обозначение говорит об абсолютной конфигурации, потому что, отметим это еще раз, условная стереохимия, разработанная в первоначальных исследованиях в этой важной области химии, случайно оказалась "абсолютно" правильной. Эти принципы могут оыть проиллюстрированы простым примером. В наименовании 5β-андростандиол-3β,16β слово "андростан" обозначает родоначальное соединение - полностью гидрированное циклопентанофенантреновое ядро с двумя метальными группами (в положениях 10 и 13) в качестве единственных заместителей со стереохимией, показанной в положениях 8, 9, 13 и 14. Конфигурация 5β показана отдельно, так как имеется много производных, в которых атом водорода при С-5 либо отсутствует, либо ориентирован противоположно. Конец названия - диол-3β,1бβ - характеризует дополнительные заместители.
В обширной области химии стероидов имеется большое разнообразие структур, в том числе содержащих в качестве заместителей длинные алифатические цепи, присоединенные к тетрациклическому ядру, или дополнительно присоединенные циклические системы. Последние в ряде случаев являются спироприсоединенными, так что новое кольцо уже не лежит в одной плоскости с тетрациклической системой. Для обозначения хиральности в этих цепях или спироприсоединенных компонентах используют символику R/S. Очень многие такие соединения наделены стереородоначальными названиями, причем фиксирующими стереохимию символами служат как α /β, так и R/S. Одним из таких соединений является гекогенин.
Как и во всех классах органических соединений, пространственные особенности, подразумеваемые в родоначальном соединении, могут быть модифицированы соответствующими указаниями в префиксе. Например, 5α,10α -андростан имеет метильную группу в положении 10 с ориентацией α; символ ζ в префиксе 5α,10ζ-андростана показывает, что ориентация метильной группы в положении 10 в этом случае не установлена. Наконец, в номенклатуре стероидов применяется и весь набор вспомогательных символов, таких как R*/S*, отн, энт, рац, (±).
Циклиты
Циклиты (циклитолы), т. е. циклоалканы, содержащие по одной гидроксильной группе при каждом из трех или более углеродных атомов в цикле, представляются родственными углеводам в силу большого числа содержащихся в них гидроксильных групп. Однако на самом деле их особенности приводят к необходимости применения специальной нумерации и специальной трактовки стереохимической номенклатуры. Ряд ранних методов, равно как и символы R/S, оказались здесь непригодными для общего применения, вследствие чего IUPAC применил новую систему, которая представляется удовлетворительной.
Обычно проекционные формулы циклитов представляют с циклогексановым кольцом, расположенным боком, и гидроксильными группами, изображаемыми линиями, перпендикулярными к боковым ("лежащим") сторонам. Такое изображение облегчает подразделение гидроксильных групп на две серии: одну серию, направленную вверх от плоскости кольца, и другую - вниз. Наименьшие локанты присваиваются атомам одной из этих серий в соответствии с правилами, разработанными IUPAC/IUB, к которым и следует обратиться для выяснения деталей. Условно нумерация начинается от верхней стороны кольца, что может потребовать такой перерисовки формулы, чтобы большинство ОН-групп было наверху. Затем относительная конфигурация описывается серией цифр. Однако СА предпочитает описывать такие конфигурации (за исключением инозита, о котором см. ниже) с помощью применяемой для стероидов системы α /β-символов.
Для описания абсолютной конфигурации формулы могут быть написаны и с циклогексановым кольцом, расположенным вертикально. Тогда если НО-группа при С-1 направлена вправо, то применяют префикс D, если влево, то префикс L. Отметим также, что если кольцо изображено боком то последовательность нумерации будет против часовой стрелки у D-соединения и по часовой стрелке - у L-соединения.
Для девяти циклогексангексаолов как правилами IUPAC/ IUB, так и СА, сохранено специальное наименование "инозит". Эти соединения различаются префиксами, написанными курсивом и отделенными дефисом; например, мио-инозит. Из этих девяти изомеров лишь два являются хиральными. Они являются энантиомерами, которые ранее назывались просто D- и L-инозитами, а теперь - D- и L-хиро-инозитами.
В указателях СА название инозит применяют как стереородоначальное и потому циклогексанпентолы, называют дезоксиинозитами. Заместители у кислорода обозначают префиксами.
Липиды
Термин липиды охватывает простые и сложные эфиры глицерина, часто являющиеся лишь небольшими компонентами больших и сложных молекул. Липиды привлекают к себе пристальное внимание как биохимиков, так и химиков-органиков. Поэтому нет ничего неожиданного в том, что специалисты IUPAC/IUB сочли необходимым опубликовать результаты обстоятельного обсуждения вопроса о номенклатуре этого класса соединений. Придуманная ранее специальная номенклатура для стереохимии липидов представляется не отвечающей требованиям биохимиков, так же как и не пригодной для разнообразия близко родственных производных. Четыре системы номенклатуры, в том числе и система R/S, были отвергнуты, и лишь разработанная Хиршманном новая система была принята IUPAC/ШВ. Она известна как "sn"-система (стереоспецифическая нумерация - stereospecific numbering) и представляется отвечающей требованиям для случаев миграции или взаимообмена О-заместителей, вызываемых ферментами (благодаря прохиральности две группы СН2ОН глицерина энзиматически различимы.).
В соответствии с "sn"-системой глицерин должен изображаться в виде проекции Фишера, с центральной ОН-группой, проектируемой во всех случаях влево, включая все производные. Затем атомы углерода молекулы глицерина нумеруются сверху вниз (1,2,3). Следствия такой нумерации можно проиллюстрировать на примере широко рчспространенной L-α-глицерофосфорной кислоты, полное название которой sn-глицеро-3-(дигидрофосфат) или sn-глицеро-3-фосфорная кислота. Затем отметим, что соединение являющееся sn-глицеро-1-(дигидрофосфатом) или sn-глицеро-1-фосфорной кислотой, не идентично sn-глицеро-3-(дигидрофосфату), а является его энантиомером, так как они не накладываются одно на другое и могут быть взаимопревращены лишь переменой мест лигандов. Других указаний, касающихся этих соотношений и противоречащих основным принципам, принятым для указателей СА, не дается.
Наиболее обычные липиды - сложные эфиры жирных кислот и глицерина - лучше всего называть аналогично сложным эфирам углеводов, а именно называя ацильную группу (или группы) в префиксах к родоначальному названию - глицерину. Например, тристеароилглицерин или тристеарат глицерина (старые названия триглицерид и тристеарин должны быть отброшены). Особый представитель липидов- (2S,3R)-2-аминооктадекандиол-1,2 имеет название сфинганин; родственные соединения называют как его производные.
Липиды, являющиеся сложными эфирами фосфорной кислоты, а именно фосфолипиды, называют систематическими названиями, например: 1,2-дистеароил-sn-глицеро-3-фосфат. Если фосфорная кислота этерифицирует две молекулы глицерина, то в названии образующегося соединения это отражается вставкой "-фосфо-", как в например: 1,2-дистеароил-sn-глицеро-3-фосфо-3-sn-глицерин.
Поскольку для многих индивидуальных липидов систематические названия не даны, часто используют родовые (характерные для данного типа) названия, мало связанные со структурой. Упомянем здесь фосфатидиновые кислоты, плазменовые кислоты, сфинголипиды и церамиды; для написания их структуры и названия их производных следует обратиться к соответствующим руководствам и правилам.
Некоторые вопросы номенклатуры природных соединений
Область химии природных соединений стара и огромна. Мы ограничиваем этот термин областью органической химии, но применяем его в широком смысле к соединениям, извлекаемым из растений, животных или микроорганизмов.
Недавние общие рекомендации IUPAC в основном подтвердили практику, используемую химиками. Обычно новому природному соединению дается тривиальное название, которое, если его строение уже установлено, характеризует его, как представителя определенного структурного типа, и подчас сохраняется, если его систематическое наименование очень длинно и нескладно. Обычно при выборе тривиального названия оно производится от названия природного источника, например: никотин - от Nicotiana tabacum, муравьиная кислота (formic acid) -от муравьев (Formica).
В этих примерах функция соединения верно отражена окончаниями слов; если химическая функция нового соединения еще не известна, то его название не должно иметь окончания, имеющего структурное значение. В практику вошло уже так много различных окончаний, что IUPAC счел желательным для новых тривиальных названий рекомендовать не вызывающие путаницы, но странные и неэстетичные суффиксы "-ун", "-уне", "-ур", ("-ург"). Будут ли они использоваться взамен давно применяемого суффикса "-ин" (инсулин, пенициллин, инулин и др.), покажет будущее.
Компромисс между структурно неинформативными, основанными на биологических соображениях, короткими названиями и систематическими, но длинными и сложными названиями, был достигнут с помощью полусистематических названий, основанных на обозначении родоначальных структур. Они рекомендованы IUPAC и названы в СА стереородоначальными структурами класса В. Обычно они выводятся для семейств природных соединений путем удаления всех функциональных групп с сохранением лишь углеводородных радикалов, создающих хиральные центры скелета; такие структуры рассматриваются как полностью гидрированные. Таким образом, простагландины, рассматриваются как производные простана, в названии которого подразумевается и конфигурация передаваемая систематическим названием. Модификацию в родоначальной структуре обозначают обычным образом с помощью префиксов и суффиксов, а их положения - локантами. Следует особо подчеркнуть, что стереородоначальное название включает абсолютную конфигурацию всех присутствующих в нем хиральных центров.
Для природных соединений известного строения, но не являющихся членами большого класса, СА трактует тривиальное название одного из наиболее распространенных соединений как стереородоначальное класса С. Такое название включает в себя как указание абсолютной конфигурации, так и указание функции. Оно может быть модифицировано обычным образом, даже с помощью префиксов для старших функциональных групп, т. е. обычно цитирующихся в суффиксах. Некоторыми, произвольно выбранными из указателей СА примерами стереородоначальных соединений класса С (о строении которых, если это интересно, можно справится в литературе) являются: рифамицин, коринан и винкалейкобластин.
Терпены
Ациклические терпены (C10H16) получают систематические названия, в то время как для родоначальных циклических монотерпенов правила IUPAC признают полусистематические названия. Структурам приписана фиксированная нумерация. Современные правила IUPAC ограничили, как не очень удачное, применение префикса "нор-", ранее принятого для обозначения родоначальных названий полностью деметилированных производных ряда циклических терпенов типа: норкаран, норпинан и норборнан.
Понятно, что родоначальные названия при наличии заместителей могут быть модифицированы с помощью обычных префиксов, например: 7-хлоро-м-ментан, или как в названии радикала (пример): пинанил-3. Для сесквитерпенов (С15Н24), дитерпенов и тритерпенов аналогичные названия правилами IUPAC не приняты, хотя многие из них находят практическое применение. В указателях СА для моно-, сескви- и дитерпенов даются полностью систематические названия, т. е. родоначальные названия здесь не признаются, тем не менее там вынуждены применять стереородоначальные названия для тетрациклических терпенов и некоторых других сложных стереохимических случаев.
Каротиноидные углеводороды (каротины) и их кислородсодержащие производные (ксантофиллы и др.) можно рассматривать как производные ликопина. Терминальные участки от С-1 до С-9 и от С-1' до С-9' могут быть ациклическими или пяти-, шестичленными циклическими структурами. Для их различия используются малые буквы греческого алфавита (α, β и т. д.). При смещении на одно положение всех двойных и одинарных связей сопряженной системы применяют префикс "ретро-" с двумя локантами. Кроме этого новшества для обозначения заместителей и других модификаций, равно как и стереохимии, применяют обычные аффиксы, как и для других классов органических соединений, в особенности стероидов. Хотя тривиальные названия каротиноидов не запрещены, они не должны применяться без одновременного приведения названия, основанного на родоначальном ликопине.
Аминокислоты
Двадцать важнейших в биогенетическом отношении α-аминокислот имеют тривиальные названия, такие, как издавно применяемые глицин или цистин; все эти названия признаны правилами IUPAC/IUB. В указателях СА применяют 30 таких стереородоначальных названий. Эти стереородоначальные названия в СА не разрешено видоизменять, а именно при описании простых солей, сложных эфиров и амидов применяют систематические названия, например: 2-аминопропанамид (а не амид аланина). Правила же IUPAC/UIB для таких производных рекомендуют применение обычных суффиксов, например: аланинамид натрия. Согласно правилам IUPAC/ IUB, даже соответствующие 20-ти аминокислотам аминоальдегиды RCH(NH2)CHO и аминоспирты RCH(NH2)CH2OH могут называться с применением соответствующих суффиксов "-аль" и "-ол", например: аланиналь и серинол. Однако для большинства химиков удобнее в подобных случаях применять достаточно простые систематические названия.
Ранние работы в области аминокислот и белков начаты примерно одновременно с работами в области углеводов. Конфигурация аминокислот основывается на таковой для L-серина (H2NCH(COOH)CH2OH). Однако в связи с тем, что все природные аминокислоты являются α-аминосоединениями, символы D/L в данном случае неизбежно относятся к асимметрическому атому, имеющему наименьший локант, в противоположность тому, как это принято в номенклатуре углеводов (основанной на приписании этих символов асимметрическому атому, имеющему наибольший локант). В настоящее время доказано, что абсолютная конфигурация L-серина отвечает символу S, как и для большинства других природных аминокислот. Специалисты детально разобрались в стереохимии полипептидов и белков, разработав сложную номенклатуру, с которой можно познакомиться в специальной литературе.
Конфигурация α-аминокислот легче всего выражается с помощью системы R/S. У большинства природных аминокислот α-С-атом имеет S-конфигурацию. В более старой системе, в качестве стандарта применявшей серии, конфигурация обозначалась буквами D и L.
Пептиды
Пептиды являются полимерами, составленными из аминокислот. Название пептидов составляется по принципу рассмотрения их как производных аминокислоты с остающейся (незамещенной) карбоксильной группой с использованием названий одной или нескольких ацильных групп в префиксах, например: аланил-S-глицин. Понятно, что белки, для которых аминокислотная последовательность не установлена, имеют только тривиальные наименования.
Названия гомополимеров (гомоолигомеров) аминокислот могут также составляться с указанием перед наименованием мономера умножающих префиксов, таких как ди-, три- или в общем случае - поли-(олиго-), например: тетраглицин. Применяется и более общая, лучше описывающая структуру пептида система, основанная на простом повторении звеньев, однако она приводит к более сложным названиям.
Правилами IUPAC/IUB приняты английские трехбуквенные сокращения тривиальных названий аминокислот, начинающиеся с прописной буквы Gly, Ala, Туг и т. д. (применяемые либо для всей молекулы аминокислоты, либо для ее радикала); особенно часто такие сокращения применяются для описания аминокислотной последовательности в пептидах и белках. Разрешена также и однобуквенная система сокращений, но она применяется гораздо реже. Имеются также правила номенклатуры, касающиеся часто применяемых сокращений для синтетических пептидов, для синтетических модификаций природных пептидов, пептидных гормонов и белков, содержащих железо и серу.
Названия ферментов (энзимов), особого класса белковых катализаторов, долгое время производились от имени субстратов, на которые они воздействуют, с небольшой модификацией окончания "-аза", или иногда характеризовались словами, описывающими их функцию. Поскольку подобная система громоздка и подчас двусмысленна, лучше применять рекомендованную IUPAC/UIB цифровую классификацию, например каталаза имеет шифр Е. С. 1.11.1.6 (Enzyme Commission - Ферментная Комиссия). Имеются специальные правила для названий смешанных форм ферментов, включая изоэнзимы.
Нуклеиновые кислоты, нуклеозиды и нуклеотиды
Имеются два хорошо известных типа нуклеиновых кислот: рибонуклеиновые кислоты (РНК) и дезоксирибонуклеиновые кислоты (ДНК). Они являются полимерами, построенными из углеводнофосфатных звеньев (соединенных в цепи остатков фосфорной кислоты и рибозы или дезоксирибозы), с присоединенными в определенные положения углеводного звена гетероциклическими основаниями (точнее, их остатками). Наиболее распространенными гетероциклическими основаниями, входящими в состав нуклеиновых кислот, являются аденин, гуанин, ксантин, гипоксантин, тимин, цитозин и урацил. Эти названия приняты IUPAC/IUB, однако в указателях СА применяются лишь систематические пурин-пиримидиновые названия. Гликозилированные основания называют нуклеозидами, и их названия чаще всего строят из названий компонентов; при этом название основания модифицируется окончаниями "-озин" или "-идин", как в случае аденозина и тимидина.
Фосфорные эфиры нуклеозидов называют нуклеотидами; для нуклеозидного остатка обычно требуется локант, например: цитидин-5'-фосфат. Наиболее широко распространенные нуклеотиды называют также, модифицируя название нуклеозида с добавлением окончания "-иловая кислота", например: 3'-уридиловая кислота.
Для всех этих соединений правилами IUPAC/IUB рекомендовано использование сокращенных обозначений и символов.
Алкалоиды
Номенклатура алкалоидов правилами IUPAC/IUB не систематизирована. Некоторые очень простые по структуре алкалоиды в указателях СА называют систематически, например никотин помещается в указателях под названием (S)-3-(l-мeтилпирролидинил-2)пиридина [(S)-3-(l-methyl-2-pyrrolidinyl)pyridine]. Названия сорока стереородоначальных соединений класса В применялись в указателях СА за 1972-1976 гг. и 1977-1982 гг.; аналогично использовались и названия многих стереородоначальных соединений класса С. Специальные структурные и конфигурационные префиксы [нор-, гомо-, секо-, ретро- и энантио- (или энт-)] применяются в своем обычном значении, за исключением отщепления метильной группы от атома азота, которое обозначается "деметил-" ("дезметил-"), а не "нор-".
Порфирины
Порфирины содержат тетрапиррольный макроцикл; коррины имеют сходную структуру, но лишенную одного мостикого атома углерода. Порфирины известны давно, в виде геминов (гемоглобины) и хлоринов (хлорофиллы). Представителем корринов является витамин B12. В указателях СА порфирины рассматриваются как производные 21H.23H-порфина, а коррины (специфическое название по IUPAC/IUB) в СА рассматривают как кобамиды и их производные. Правилами IUPAC/IUB для корриноидов разрешено использование некоторых сокращений.
Витамины
Структурно витамины относятся к самым различным классам органических соединений. Их биологическая активность, пожалуй, лучше всего ассоциируется со старыми буквенными обозначениями: говорят, например, А-витаминная активность.
Изотопно-модифицированные соединения
Изотопно-модифицированными называют соединения, в которых изотопный состав нуклидов отличается от имеющегося в природе. При написании формул и названий таких соединений изотоп (нуклид), присутствующий в избытке, обозначают символом атома с массовым числом в левом верхнем индексе этого символа, например 14С . Для изотопов водорода в соединениях, не модифицированных иными изотопами, приемлемы также символы D и Т; в СА вместо них используют d и t.
Следует различать два типа изотопно-модифицированных соединений: изотопно замещенные, в которых практически все молекулы имеют определенный нуклид в определенном положении, и изотопно-меченные, которые являются смесью изотопно немодифицированных с одним или несколькими изотопно замещенными аналогами, причем обычно немодифицированные преобладают в этой смеси. На практике, в меченых соединениях обычно присутствуют радиоактивные нуклиды, а изотопно-замещенных - стабильные нуклиды.
Согласно IUPAC название для изотопно-замещенного органического соединения образуют, ставя символ нуклида (при необходимости с локантом) перед всем названием или перед его изотопно-замещенной частью. Как это вообще принято при замещении, при необходимости указывается число замещенных атомов. Это дает названия типа (2-13С)бутен-1 и метил(2Н2).
В СА не различают изотопно-замещенные и изотопно-модифицированные соединения и используют курсивные суффиксы (ко всему соединению или его части) для указания положения и природы модифицирующих нуклидов. Два приведенных выше соединения получают названия l-butene-2-13C, methylacetate-(2H2).
Система, близкая к принятой в СА, но предписывающая заключать курсивные суффиксы в квадратные скобки, кратко описана в правилах IUPAC для неорганических соединений; она приводит к таким названиям, как трихлорид [32P]фосфора для 32РСl3. Следует надеяться, что эта система будет оставлена в пользу способа IUPAC, применяемого в органической химии, или способа СА.
В случае меченых соединений символ нуклида заключают в квадратные скобки (вместо круглых, используемых для изотопно замещенных соединений). Для специфически меченных соединений, таких как хлоро[3Н3]метан, когда число нуклидов и их положение известно, названия и формулы напоминают таковые для изотопно замещенных соединений. Аналогично поступают с соединениями, специфически меченными многократно одинаковыми или разными нуклидами.
Селективно меченными называют соединения, у которых известны положения, но не число нуклидов. Формулы в этих случаях записывают без умножающих цифр, помещая обозначения нуклидов, как обычно, в начале, например [2,3-14C]пропанол-1. В названиях неселективно меченных соединений используют квадратные скобки, но без локантов и множителей, например: [14С]аланин. Если мечены все положения селективно меченного соединения, в название вводят букву G, например: [G-3H] пиридин. Если известно, что все положения мечены с одинаковым соотношением изотопов, то используют букву U в аналогичной записи, например: [U-14С]аланин.
Согласно правилам IUPAC, в изотопно-модифицированных соединениях сохраняется нумерация, принятая для соответствующих немодифицированных аналогов, например в (2Н)СН2СН2I, 1-иодо-2-(2Н)этане, нумерация начинается с С-атома, связанного с иодом. Конечно, в соединении СН3[14С]Н2СН2СН3 меченый С-атом имеет локант 2, а не 3. Однако в практике СА модифицированный нуклид старше всех других префиксных заместителей, поэтому (2Н)СН2СН2I называют в СА 2-iodoethane-1d. Иногда модифицированный нуклид занимает ненумерованное положение; в этом случае роль локанта выполняет курсивный префикс; примером может служить название для С6Н5СНОНС(=18О)С6Н5 - [карбонил-18О]бензоин или бензоин-карбонил-18О.
Полимеры
Как и во многих других областях химической номенклатуры, для полимеров используют наименования двух типов. В названиях, основанных на строении, указывают повторяющиеся атомы или группы; более старые названия, основанные на происхождении или способе получения полимера, образуют из префикса "поли" и названия мономера. Иногда последняя система условна, поскольку, например, поли(виниловый спирт) в действительности не получают полимеризацией винилового спирта.
Несмотря на большую целесообразность структурных названий, которые с 1972 г. приняты в СА, мы сначала рассмотрим более старые названия. Они широко используются, в особенности в технологии и биохимии, а также признаются правилами IUPAC. Допустимые сокращения таких названий также перечислены в издании IUPAC. Так, например, полиэтилен, ПЭ; полиэтиленоксид, ПЭО; поли(этилентерефталат). Обратите внимание на использование скобок, которые необходимы для того, чтобы различить, например, поли(хлорометилакрилат), являющийся полимеризованным хлорометилакрилатом, и полихлорометилакрилат, который имеет другую структуру; в этом случае пригодно также название полихлоро(метилакрилат). Сополимеры (в отличие от гомополимеров) называют, вставляя частицу "со" между названиями мономеров, например: поли(акрилонитрил-со-стирол).
Линейные полимеры с координационной структурой обозначают префиксом катена-.
Строение линейных органических полимеров обычно указывают, описывая минимальное повторяющееся звено. Эта система в настоящее время применяется в СА, а также допускается IUPAC, однако в последнем случае упомянутые звенья называют "структурно повторяющимися единицами". Такая единица может быть простой двухвалентной группой или комбинацией их. В этих случаях название группировки, взятое в квадратные скобки, ставится за префиксом "поли". В случае несимметричного повторяющегося звена, поскольку возможно его написание и наименование в двух направлениях, необходимо, чтобы правила определяли начало и направление перечисления. Такое требование делает правила сложными.
Рекомендации IUPAC распространяют генетические названия на линейные полимеры. Полимеры, содержащие лишь небольшое число повторяющихся звеньев, называют олигомерами. Полимер, построенный из небольших одинаково повторяющихся в своей последовательности звеньев, называют регулярным; значительно отличающиеся (особенные) участки полимера называют блоками. Регулярные полимеры могут быть тактическими, изотактическими или синдиотактическими (часто стереорегулярными), однако для определения этих терминов, указывающих конфигурацию, следует обратиться к тексту правил. Существуют специальные правила для описания конформации пептидных цепей.
Фуллерены
Фуллерены - это соединения, состоящие исключительно из атомов углерода, соединенных в конденсированную поликарбоциклическую систему каркасного типа, состоящую из пяти- и шестизвенных циклов. Фуллеранами называют полностью гидрированные фуллерены: C60H60, C70H70. Гетерофуллерены, норфуллерены, гомофуллерены, а также секофуллерены называют фуллероидами. По систематической номенклатуре фуллерен C60 рекомендуется называть (C60-Ih)[5,6]фуллерен, а C70 - (C70-D5h(6))[5,6]фуллерен. В круглых скобках указывается содержание атомов углерода и символ точечной группы для рассматриваемой молекулы, а цифры в квадратных скобках означают размеры циклов в фуллерене.
Атомы в (C60-Ih)[5,6]фуллерене и (C70-D5h(6))[5,6]фуллерене по систематической номенклатуре нумеруют руководствуясь правилами. Правило 1: одна из осей симетрии выбирается в качестве реперной, причем выбор производят, начиная с осей более высокого порядка. Для этой оси должен существовать по крайней мере один последовательный спиралевидный спуск, начинающийся либо в кольце, через центр которого эта ось проходит, либо на конце связи, которую она делит пополам, либо на атоме, через который она проходит. Нумерация начинается на конце этого спуска. Правило 2: а) если есть выбор между осями одного и того же порядка, то предпочтение отдается той, которая проходит через кольцо, затем той, которая через связь, а затем той, которая черз атом; б) если есть выбор между кольцами, то предпочтительней кольцо большего размера, т.е. шестизвенное; в) если есть выбор между связями, то предпочтительней та, которая лежит на сочленении больших по размеру колец (6:6 > 6:5 > 5:5); г) если есть выбор между атомами, то предпочтительней тот, который является общим для больших по размеру колец. Правило 3: в тех случаях, где остается выбор спиралевидного спуска для нумерации, предпочтительным спуском является тот, который ближе (по числу связей) к оси спирали.
Добавление неотделяемого префикса "гомо" перед родоначальным названием означает внедрение в одну из связей фуллерена группы CH2 с сохранением прежней нумерации молекулы. Положение "нового" атома углерода фиксируется сложным локантом, состоящим из цифровых локантов атомов, между которыми внедрена метиленовая группа (больший из которых берется в круглые скобки) и буквы "a", если между атомами внедрена одна группа, "b" если две подряд и т.д. Пример: 1aH-1(9)a-гомо(C60-Ih)[5,6]фуллерен.
Неотделяемы префикс "нор", стоящий перед основой названия, указывает на удаление атома углерода из родоначального соединения. Перед префиксом приводится локант того атома, который был удален, а общая нумерация атомов остается прежней. Пример: 2H-1-нор(C60-Ih)[5,6]фуллерен.
Секофуллерен - это фуллерен с удаленной связью. Перед неотделяемым префиксом "секо" через запятую пишется пара локантов, которая соответствует удаленной связи. Нумерация атомов соответствует нумерации атомов родоначального фуллерена. Освободившиеся валентности, как и в случае норфуллеренов, "заполняют" атомами водорода. Пример: 1,9-секо(C60-Ih)[5,6]фуллерен
Фуллерены, в которых атом(ы) углерода земенен(ы) на гетероатом(ы), называют с использованием "а"-номенклатуры. Присутствие трехвалентного гетероатома в структуре может привести к необходимости указать в названии "обозначенный водород". Пример: 2H-1-аза(C60-Ih)[5,6]фуллерен.
Фуллерены имеют достаточно большую полость для того, чтоб заместители могли располагаться не только снаружи сферы, но и внутри ее. Такие "внутрение" заместители в названии обозначаются дескриптором "эндо", который записывают в круглых скобках после соответствующего локанта. Пример: 1,7(эндо)-дибром-1,7-дигидро(C60-Ih)[5,6]фуллерен.
Краун-эфиры и криптанды
Макроциклические эфиры, имеющие в качестве электронодонорных атомов только атомы кислорода, называются краун-эфирами. Если атомы кислорода замещены на азот или серу такие соединения называются соответственно азакраун- и тиакраун-эфиры.
Так как названия в соответствии с правилами ИЮПАК для таких соединений слишком сложны, Педерсен предложил более удобные краткие названия.
Предложенные им общие правила номенклатуры краун-соединений состоят в следующем. Название краун-эфира, имеющего ароматические или циклогексановые кольца, включает: 1) тип и число замещенных в полиэфирном кольце групп; 2) общее число атомов, ограничивающих полость, которые составляют кольцо краун-соединения; 3) термин "краун"; 4) число атомов кислорода, т.е. число эфирных звеньев в кольце краун-соединения, соединенных дефисами. Например, бензо-15-краун-5, дициклогексил-18-краун-6.
Эти правила не всегда точно могут описать тип связи в соединении и положение заместителей, однако очень удобны для обычных краун-эфиров с симметричными или сравнительно простыми структурами.
Для криптандов Лен предложил номенклатуру, согласно которой для типа и числа гетероатомов, входящих в кольца, и типа заместителей используются цифры или буквы, заключенные в квадратные скобки. Например, криптанд[2,2,2].
Катенаны и ротаксаны
Номенклатура предложена Шиллом Г. Слово "катенан" или "ротаксан" ставится в конце названия обозначаемого соединения. В начале названия в квадратных скобках указывается число молекулярных составляющих. Таким образом группа простейших катенанов будет названа [2]-катенаны. После скобок следуют названия молекулярных составляющих, которые также заключены в квадратные скобки. Циклы катенана нумеруются по аналогии с нормальными или разветвленными парафинами; номер каждого цикла помещается перед его названием. Примеры: [2]-[циклоэйкозан]-[циклоэйкозан]-катенан, [3]-[циклоэйкозан]-[циклогексакозан]-[циклоэйкозан]-катенан (линейная связь циклов), [3]-[1,20-диарилэйкозан]-[циклоэйкозан]-[циклоэйкозан]-ротаксан.
Для разветвленных катенанов, где с одним циклом связано более чем 2 кольца, названия циклов, образующих ответвления от главной цепи, нумеруются подстрочными значками и помещаются в те же квадратные скобки, что и название цикла, от которого они ответвляются. Примеры: [4]-1-[циклоэйкозан]-2-[циклодотриаконтан-21-циклоэйкозан]-3-[циклоэйкозан]-катенан (на центральное циклодотриаконтановое кольцо одеты 3 циклоэйкозановых кольца), [4]-1-[циклогексакозан]-2-[циклогексакозан]-3-[циклотриаконтан]-4-[циклогексакозан]-циклокатенан (4 кольца последовательно связаны в цикл).
Некоторые устаревшие приставки (префиксы) и окончания (суффиксы)
алло- - приставка, обозначающая, что данное соединение по строению сходно с другим. Например, кофеин и аллокофеин. В случае геометрической изомерии соединений с двойной связью обозначает более стабильную форму в котрую превращается соединение при нагревании. Например, фумаровую кислоту можно назвать алломалеиновой, так как она образуется при нагревании малеиновой кислоты.
амфи- - приставка, обозначающая 2,6-замещенные нафталины.
она- - приставка, обозначающая 1,5-замещенные нафталины.
анти- - приставка для обозначения стереоизомеров. Часто также применяется для обозначения стереоизомерных оксимов и гидразонов и указывает на диагональное расположение групп по отношению к плоскости двойной связи. Одностороннее положение групп обозначается приставкой син-.
аци- - приставка, обозначающая кислотную таутомерную форму нитросоединений.
виц- - приставка, обозначающая земещение у соседних атомов.
втор- - приставка, обозначающая заместитель имеющий вторичный атом углерода.
гем- - приставка, обозначающая двойное замещение у одного атома углерода.
гомо- - наиболее часто обозначает гомолог, длиннее на одну CH2 группу.
изо- - приставка, указывающая на разветвленное строение цепи углерода.
ката- - приставка для обозначения 1,7-замещенных нафталина.
мета- (м-) - приставка, обозначающая 1,3-замещенные бензола.
омега- (ω-) - приставка, обозначающая что заместитель связан с крайним атомом углеродной цепи.
орто- (о-) - приставка, обозначающая 1,2-замещенные бензола.
пара- (п-) - приставка, обозначающая 1,4-замещенные бензола.
перв- - приставка, обозначающая заместитель имеющий первичный атом углерода.
пери- - приставка, обозначающая 1,8-замещенные нафталины.
псевдо- - приставка, обозначающая изомерную форму.
прос- - приставка, обозначающая 2,7-замещенные нафталины.
ряд- - приставка, обозначающая расположение заместителей у нескольких соседних атомов углерода.
симм- - приставка для обозначения симметричных структур.
трео- - приставка, обозначающая, что в соединении два смежных ассиметрических центра имеют одинаковую конфигурацию. В противоположность, приставка эритро- указывает на то что два центра имеют различную конфигурацию.
трет- - приставка, обозначающая заместитель имеющий третичный атом углерода.
эпи- - приставка, обозначающая 1,6-замещенные нафталины.
Отличия русской номенклатуры от утвержденной номенклатуры ИЮПАК
Правила составления названия
1 этап. Первое, что следует сделать, это выбрать все имеющиеся в соединении замещающие группы: ОН, NH2, COOH, SO3H, ОСН3, СООС2Н5 и др. Если в молекуле нет заместителей то можно сразу перейти ко второму этапу.
Затем выбрать старшую группу. Порядок групп в порядке убывания их старшинства такой:
1. свободные радикалы,
2. радикал-анионы,
3. радикал-катионы,
4. анионы,
5. цвиттер-ионные соединения,
6. катионы,
7. кислоты в следующем порядке: карбоновые, пероксикислоты, затем последовательно их S- и Se-производные, далее сульфоновые, сульфиновые кислоты, селеноновые и т.д., фосфоновые и т.д., арсоновые и др.,
8. ангидриды (циклические ангидриды называются как производные гетероциклов),
9. сложные эфиры,
10. ацилгалогениды,
11. амиды,
12. гидразиды,
13. имиды,
14. нитрилы,
15. альдегиды, затем последовательно их S-, Se- и Te-аналоги, затем их производные,
16. кетоны, их аналоги и производные в той же последовательности, что и для альдегидов,
17. спирты, затем фенолы, затем S- и Se-аналоги спиртов, затем сложные эфиры спиртов с неорганическими кислотами (кроме галогеноводородных), затем аналогичные производные фенолов в той же последовательности,
18. гидропероксиды,
19. амины,
20. имины.
Эта, и только эта, группа указывается в суффиксе, а все остальные помещаются в виде префиксов.
Только в виде префиксов указываются следующие функциональные группы:
-Br бром
-Cl хлор
-ClO хлорозил
-ClO2 хлорил
-ClO3 перхлорил
-F фтор
-I иод
-IO иодозил
-IO2 иодил (ранее: иодокси)
-I(OH)2 дигидрокси-λ3-иоданил
-IHal2 дигало-λ3-иоданил (ранее: дигалоиод)
=N2 диазо
-N3 азидо
-NO нитрозо
-NO2 нитро
-OR R-окси
-SR R-сульфанил (ранее: R-тио)
-SeR R-селанил (ранее: R-селено)
-TeR R-телланил (ранее: R-теллуро)
-SH3 λ4-сульфанил.
Главная группа лежит в основе всего названия и нумерации, и поэтому она должна быть выбрана прежде всего. Это иллюстрируют два следующих простых примера: соединение С10Н7С6Н4СООН следует называть нафтилбензойной кислотой, а не (карбоксифенил)нафталином, в то время как соединение С6Н5С10Н6СООН следует называть фенилнафтойной кислотой. NH2CH2CH2OH называют 2-аминоэтанолом, но не 2-гидроксиэтиламином, так как ОН-группа старше, чем NH2-rpyппa.
Что касается остального названия, то оно строится на базе этой (определяющей) группы.
2 этап. Выбор главной цепи.
В первую очередь выбирается цепь или цикл к которому присоединена главная группа. Если главных групп несколько к главной цепи или циклу должно быть присоединено максимально возможное количество старших групп.
Если в цепи присутствуют гетероатомы, то они располагаются по страшинству в следующий ряд: N > P > As > Sb > Bi > Si > Ge > Sn > Pb > B > Al > Ga > In > Tl > O > S > Se > Te > C. Например: CH3-PH-SiH3 - метил(силил)фосфан (так как P старше Si и C).
Если в молекуле присутствует цикл и цепь без главных групп или с одинаковыми главными группами, то цикл считается старше, чем цепь, независимо от степени ненасыщенности. При наличии двух циклов без старших групп и с одинаковыми старшими группами, старший цикл выбирается в следующем порядке: (1) гетероцикл, (2) в цикле по крайней мере один атом азота, (3) в цикле хотя бы один гетероатом отличный от азота, (4) содержит наибольшее число циклов, (5) имеет наибольший число атомов в скелете цикла, (6) имеет наибольшее число гетероатомов. Для полициклических систем порядок такой: (1) спиросистемы, (2) циклические фаны, (3) конденсированные циклы, (4) мостиковые конденсированные циклические системы, (5) неконденсированные мостиковые системы, (6) линейные фаны, (7) ассамбли циклов. Если все перечисленные критерии не разрешили ситуацию, то используются следующие критерии: (1) цикл с наибольшим числом кратных связей, (2) с наибольшим числом двойных связей, (3) с одним или больше числом атомов с нестандартным числом связей, (4) имеет наименьший локант у обозначенного водорода, (5) имеет наименьшие локанты у гетероатомов, (6) конденсированная система имеет меньший локант у углерода в месте стыка колец, (7) старшая группа имеет наименьший локант, (8) место соединения цикла имеет наименьший локант, (9) кратная связь имеет наименьший локант, (10) наименьший локант у префикса "гидро-", (11) наибольшее число изотопно-модифицированных атомов, (12) изотопно-модифицированный атом имеет более тяжелый нуклид, (13) изотопно-модифицированный атом имеет наименьший локант, (14) Z-изомер старше E-изомера, (15) R-изомер старше S-изомера.
Пример построения названия:
(1) Предположим, что имеется лишь один тип главной замещающей группы и что она присоединена к алифатической цепи. Если, кроме того, в соединении имеется лишь одна группа данного типа, то выбираем наиболее ненасыщенную цепь, к которой эта группа присоединена. (Для выбора родоначального названия СА теперь предпочитает наиболее длинную цепь, до рассмотрения вопроса о ненасыщенности). Если имеется несколько групп одного типа, т. е. более чем одна главная группа, присоединенная к алифатической цепи, то выбирают неразветвленную цепь, содержащую наибольшее число таких групп. Если имеются две таких цепи, то предпочтение отдается более ненасыщенной, затем более длинной, как и в предыдущем случае. Затем цепь нумеруют с учетом ненасыщенности и замещения, при этом наименьший возможный номер (или номера) получает атом (или атомы) углерода, несущий главную группу (или группы), как это будет показано в дальнейшем. Наконец, называют цепь, добавляют суффикс для главной функциональной группы (или групп), называя другие заместители в префиксах, вводя их в алфавитном порядке, и таким образом получают полное названиe. В дальнейшем будут рассмотрены более сложные случаи.
(2) Предположим, что главная функциональная группа присоединена к циклу. Называют циклическую систему, как это будет объяснено ниже, нумеруют ее, приписывая наименьший из возможных номеров гетероатому, затем углеродным атомам, несущим "обозначенные" атомы водорода, если они имеются, затем атомам, связанным с главной группой, и наконец, атомам, которые связаны с другими атомами и группами, названия которых должны быть включены в название соединения в префиксах.
(3) Если главная функциональная группа присоединена к цепи, а та, в свою очередь, присоединена к циклу, то цикл можно трактовать как радикал, замещающий цепь, или использовать соединительную номенклатуру.
(4) Для соединений с симметричной структурой типа X-Y-X применим вариант описанных выше процедур, если звенья X содержат одинаковые главные группы, указываемые в суффиксах. В качестве примера можно привести формулы п-НООССН2-С6Н4-СН2СООН и H2NCH2CH2-О-CH2CH2NH2. Принцип заключается в указании групп X с префиксом "ди" и помещении их перед названием двухвалентной группы Y (например, фенилен или окси в приведенных выше примерах).
В каждом из описанных случаев (1) - (4) имеется лишь немного стадий, и придерживаясь правильной последовательности, можно получить верный ответ. Даже несмотря на то, что наши указания упрощены и часто встречаются значительно более сложные случаи, можно лишь удивляться, до чего же большое число соединений, встречающихся в обычной практике органической химии, можно правильно называть, пользуясь этими указаниями. Конечно, легче сказать "назовите цикл", чем сделать это, так как при этом часто встречаются сложные проблемы. На последующих страницах уточняются и разъясняются приведенные выше приемы составления названий и обсуждается ряд проблем, но для этого надо вновь начать все последовательно.
Завершающий подход к названию
Теперь, когда проблемы главных групп и нумерации разобраны, можно дополнить приведенные выше общие положения. Исходным пунктом остается главная группа, как это было и при рассмотрении вопроса о нумерации. Единство в этом пункте очень важно для того, чтобы быть уверенным, что название и нумерация идут параллельно. Если в соединении нет главной группы, то построение названия упрощается, префиксы добавляются потом. Для алифатических соединений родоначальной является главная цепь, к ней добавляется суффикс, характеризующий главную группу, например: гексанол-2. Если возможен выбор между цепями, то по правилам IUPAC предпочтение отдается более ненасыщенной цепи, как в названии 2-пропилбутен-2-ол-1, хотя эта цепь может быть и не самой длинной. В СА используется иной подход, и эта же структура здесь получает название 2-ethylidene-l-pentanol (2-этилиденпентанол-1). Если имеется возможность выбора между цепями с равной степенью гидрирования, то, конечно, предпочтение отдается более длинной цепи.
Таким образом, названия соединений основываются на их структуре, а не на генетической связи между двумя (и более) соединениями, кажущимися сходными. Смысл этого заключения в том, что часто можно обнаружить взаимосвязь не с одним, а с несколькими соединениями, и тогда выбор названия становится не столь (как это кажется с первого взгляда) однозначным.
Обозначить несколько групп одного типа, присоединенных к единой цепи или циклической системе, не составляет труда; названия гександиол-3,4 или бензолтетракарбоновая-1,2,3,4 кислота не вызывают сомнений. При разветвлении цепи следует принимать во внимание дополнительные правила. Соединение СН3СН2СН2СН2СН(СН2ОН)СН2СН(ОН)СН3 должно быть названо так, чтобы обе функциональные группы отражались суффиксом, добавляемым к наименованию главной цепи. Правильным названием данного соединения будет 2-бутилпентандиол-1,4, а не 2-(2-гидроксипропилгексанол)-1, несмотря на то, что последнее название содержит более длинную цепь (из шести С-атомов), чем правильное первое (из пяти С-атомов).
Принцип, изложенный в предыдущем абзаце, часто называют "принципом подобия". Вообще говоря, было бы действительно неплохо так строить названия веществ, но этот принцип нельзя возвести во всеобщее правило, так как часто возникает вопрос, какова степень подобия? В любом таком случае, когда возникает сомнение, принцип сам себя изживает. Рассмотрим, например, простой триол CH(CH2CH2OH)3. В данном случае название должно основываться на пентановой цепи, содержащей две гидроксильные группы, оставляя третью гидроксильную группу в боковой цепи. Правильным названием этой структуры будет (2-гидроксиэтил)пентандиол-1,5. Могла бы существовать система номенклатуры, согласно которой это соединение называли 2-этилпентантриолом-1,5,2'. Однако в действительности такая система не применяется, и это название следует считать ошибочным.
Более распространены разветвленные цепи, дающие возможности выбора из нескольких вариантов главной цепи. Рассмотрим выбор между различными цепями, содержащими равное число идентичных групп. Поскольку в соединении (HOCH2CH2CH2CH2)2CHCH=CHCH2OH имеются идентичные главные группы, дополнительное правило отдает предпочтение ненасыщенной цепи, и, следовательно, это соединение следует называть 4-(4-гидроксибутил)октен-2-диол-1,8. Включение двух насыщенных фрагментов в главную цепь приводит к названию 5-(3-hydroxy-l-propenyl)-l,9-nonanediol [5-(3-гидроксипропенил)нонандиол-1,9], принятому в СА. При отсутствии различия в степени ненасыщенности выбирается наиболее длинная цепь, и таким образом насыщенный аналог этого соединения получает название 5-(3-гидроксипропил)нонандиол-1,9.
Методы и принципы построения названий, описанные выше, в равной мере применимы и в случае, когда главная группа присоединена непосредственно к циклической системе. Для более сложных циклических систем построение полного названия в действительности обычно упрощается (особенно после того, когда названа родоначальная циклическая система) уже потому, что, хотя бы частично, фиксирована нумерация. Для более простых циклических систем, и в частности для ароматических, построение систематических названий значительно осложняется, отчасти в силу старых традиций, отчасти потому, что огромное число этих соединений имеет тривиальные наименования, которые, естественно, будут распространяться и на их производные. Строгое применение правила, что главная группа должна называться в суффиксе, практикуется сравнительно недавно, в особенности для циклических соединений. Имеется много случаев, когда построенные согласно этому правилу названия могут показаться непривычными или даже шокирующими для химиков старшего поколения. Например, названия 2,3-дигидроксинафталин или 2-аминофенантрен могут оказаться для них более привычными, нежели правильные названия: нафталиндиол-2,3 или фенантренамин-2. Есть еще один камень преткновения, это вопрос о построении названий азотистых гетероциклических систем. Окончание "ин" в названии пиридин можно принять за суффикс главной группы, однако если в соединении содержится ОН- или СООН-группа, то в суффиксе должны называться они, и названиями таких веществ должны быть, например, пиридинол-2 или пиридинкарбоновая-4 кислота. Так они и называются по правилам IUPAC. Считать в данном случае окончание "ин" суффиксом ошибочно. Поскольку это так, то названия, подобные пиридинамину-2, вполне удовлетворительны, это современные названия, и их применение рекомендуется.
Ситуация проще в случае соединений, содержащих и циклическую систему, и боковую цепь, причем все функциональные группы присоединены либо к той, либо к другой части молекулы. В таком случае родоначальное название определяют именно эти группы, например м-пропилфенол или 3-фенилпропанол-1 (в СА: benzenepropanol).
Из сказанного выше следует, что никогда не надо забывать о конъюнктивной номенклатуре. Сложные случаи могут возникнуть когда главные группы присоединены и к боковой цепи, и к циклической системе, так что все они не могут быть приведены в суффиксе. Тогда в качестве родоначального соединения следует выбирать или циклическую систему, или боковую цепь. Обычно выбор падает на более сложную или более существенную с химической точки зрения часть молекулы, не взирая на что оба эти критерия очень сильно зависят от личного вкуса автора. Мало кто возразит против таких названий, как 8-(п-гидроксифенил)октатриен-2,4,6-ол-1 или 1-О-(п-гидроксифенил)глюкоза, но выбор одного из трех названий: 3-(п-гидроксифенил)-пропанол-1, 4-hydroxybenzenepropanol (принятое СА) или п-(3-гидроксипропил)фенол, будет зависеть от того, в каком контексте эти соединения обсуждаются.
Следует быть внимательным и тогда, когда главные группы локализованы в нескольких цепях или циклических системах, являющихся частями одного соединения. В правилах IUPAC изложены критерии установления старшинства различных цепей и различных циклических систем. В общем, старшим является более сложный фрагмент, однако правила выбора старшинства следует тщательно изучить.
Наконец, имеется номенклатура, в которой учитывается тот факт, что органический синтез часто приводит к симметрично построенным соединениям общего типа X-Y-X, где обе группы X содержат одинаково локализованные главные группы, не содержащиеся в группе Y. Если X и Y не являются алифатическими или циклическими группами или если Y является гетеро-группой, то можно построить вполне понятные приемлимые названия, пользуясь специальными дополнениями к обычным правилам. Примерами могут служить соединения п-(HOOCCH2)2C6H4 и H2NCH2CH2OCH2CH2NH2. В первом из них два остатка уксусной кислоты должны указываться как "уксусная кислота", сдвоенные префиксом "ди", а группа С6Н4, называемая "фенилен", записывается впереди, предшествуемая буквенным локантом. В результате полное название этого соединения будет п-фенилендиуксусная кислота; оно так же четко описывает строение, как наименование фенилуксусная кислота описывает строение соединения С6Н5СН2СООН. Аналогично, второе соединение называется 2,2'-оксиди(этиламином), где скобки поставлены для того, чтобы отличить два диэтиламинных остатка от соединения (C2H5)2NH - диэтиламина. Номенклатура, применяемая СА, аналогична, только вместо префиксов ди-, три- и т. д. там используют префиксы бис-, трис- и т. д. и, кроме того, последующую часть названия заключают в скобки, независимо от того, является ли оно простой или сложной. Таким образом, по СА эти соединения получают названия p-phenylenebis(acetic acid) и 2,2'-oxybis(ethanamine) соответственно. Этот метод довольно широко распространен. В качестве Y могут выступать: >СО карбонил, >СН2 метилен, -СН2СН2- этандиил-1,2 (этилен), -СН2СН2СН2 - пропандиил-1,3 (триметилен) и т. д., -S - тио, >CS тиокарбонил, >NH имино, -N = N- азо и др. Далее, этот принцип может быть распространен на трехвалентные радикалы, например: N(CH2COOH)3 является нитрилотриуксусной кислотой. Наконец, сама группа Y может быть сложной и симметричной.
Следует, однако, предупредить, что этот метод нельзя применять при неполной симметричности обеих групп X или при отсутствии симметрии замещения в Y.
Из всего сказанного должно быть ясно, что построение названия не всегда сводится к формальному соблюдению правил. Несмотря на то, что в удивительно большом числе случаев правил обычных тривиальных или простых систематических названий вполне достаточно, все же следует еще раз подчеркнуть, что хотя без достаточных на то оснований правила не следует нарушать, но и химию забывать не следует. Разнообразие номенклатуры органических соединений в действительности возникает из-за естественного желания отразить в названии химические взаимосвязи. При этом и возникают трудности, когда многообразие химических взаимосвязей приводит к созданию противоречивых названий или когда частными правилами начинают пользоваться за пределами отведенных для них областей. Когда подобная ситуация возникает, целесообразно вернуться к систематическим названиям, являющимся, безусловно, опорой в номенклатуре. Очень существенно правильно оценить возможности и границы систематического подхода, прежде чем решиться отойти от него.